-
Gebiet der Erfindung
-
Das
technische Gebiet der Erfindung ist die Kapillarelektrophorese.
-
Hintergrund
der Erfindung
-
Kapillarelektrophorese
(CE) hat wachsende Bedeutung für
die Durchführung
chemischer und biochemischer Verfahrensweisen erlangt. Sie liefert
viele Vorteile einschließlich
wesentlicher Ersparnisse bei Analysedauer, Analysekosten, dem benötigten Laborraum,
der für
Durchführung
der Analyse, Automatisierung und hohen Durchsatz erforderlich ist.
Diese Vorteile beruhen zum großen
Teil auf Miniaturisierung und Minderung von damit verbundenen durch
Menschen verursachten Faktoren, z.B. Laborkosten, Kosten, die auf
Durchführungsfehler
zurückzuführen sind,
und allgemeine Unbeständigkeiten
von Mensch zu Mensch und der gesamten vom Menschen durchgeführten Arbeitsschritte.
-
Aufgrund
von Faktoren wie Eignung, Kosten und Effektivität ist die Verwendung von Materialien
aus Kunststoff auf dem Gebiet der CE sehr attraktiv geworden. Zum
Beispiel können
herkömmliche
Formungsverfahren verwendet werden, um große Anzahlen von Einmalgeräten aus
Kunststoff herzustellen, von denen jedes präzise und komplizierte Formen
aufweist, wie etwa Mikrokanalnetzwerke und -reservoirs. Kunststofffilme können gleichfalls
effizient in Laminate ausgezogen werden, die elektrophoretische
Kanäle
enthalten. Zahlreiche Kunststoffe oder Polymere können verwendet
werden und sind bei den vorstehend genannten Formprodukten und Filmen
verwendet worden. Diese umschließen unter anderem Polymethacrylate
und andere Acrylprodukte, Polycarbonate, Polydimethylsiloxane und
Polyalkene. Die Probleme mit jedem einzelnen Stoff jedoch bestehen
in den komplexen Oberflächenchemien,
begleitet von Variationen bei Oberflächenladung, physikalischer
und chemischer Konfiguration und Mikrostruktur der Wand. Diese chemischen
Eigenschaften und Oberflächenladungen
neigen dazu, Adsorption der Proben an die Kapillarwände zu erschweren
und einen nicht einheitlichen elektroosmotischen Fluss zu erzeugen.
Da Adsorption zu schiefen Peaks und/oder zu keiner Analyt-Wanderung
führt,
während
nicht einheitlicher elektroosmotischer Fluss herabgesetzte Auftrennungsauflösung verursacht,
war es bisher schwierig, verlässliche
und beständige
Ergebnisse zu erhalten.
-
EOF
ist in hohem Maße
sowohl vom Zeta-Potential als auch von der Viskosität in der
Nachbarschaft einer festen Mikrokanalwand abhängig. Das Zeta-Potential ist
das Potential an der Reibungsfläche
("shipping" Scheroberfläche) zwischen
der geladenen oder ionisierten Oberfläche und der Elektrolytlösung oder
Pufferlösung,
abhängig
von der Dichte der Oberflächenladung,
der Zusammensetzung der Pufferlösung
oder des Mediums und dem pH-Wert. Dieser Effekt ist bei einer Reihe
von Substraten anzutreffen. Wenn zum Beispiel eine herkömmliche
Silikakapillare für
die CE verwendet wird, wird EOF aufgrund der negativ geladenen inneren Wände der
Kapillare verstärkt.
Diese Wände
werden von Silanol-Gruppen beherrscht, die eine diffuse Schicht mit überschüssigen positiven
Ionen aus der Elektrolytpufferlösung
anziehen. Da die beweglichen überschüssigen positiven
Ionen in der diffusen Schicht unter dem Einfluss eines elektrischen
Potentials in Richtung der Kathode fließen, wird die Gesamtlösung ebenfalls
in die selbe Richtung gezogen.
-
Zur
Zeit gibt es mehrere Wege, EOF und Adsorption zum Teil oder vollständig zu
kontrollieren, einschließlich
dem Wechsel von Pufferlösungen
und Zusätzen,
der Verwendung von organischen Lösungsmitteln, Adsorption
von neutralen und/oder elektrisch geladenen Makromolekülen (einschließlich grenzflächenaktiven Mitteln)
an der Wand, chemisch gebundener Phasen und dergleichen. Vgl. zum
Beispiel US-Patent
Nr. 4,68,201, 4,690,749, 4,865,707, 4,931,328, 5,112,460. Die zugrunde liegende
Idee ist, die Natur der elektrischen Ladungen an der Wand zu verändern, um
elektrisch geladene Einheiten wesentlich zu reduzieren. Jedes dieser
Verfahren hat Nachteile und kann nicht die gewünschte Reduktion von EOF liefern,
während
gleichzeitig andere erwünschte
Oberflächeneigenschaften
zur Durchführung
der CE bestehen bleiben.
-
Die
Verwendung von auf Norbornen basierenden Polymeren als einem Trennmedium
bei der Elektrophorese ist in dem österreichischen Patent Nr.
AT404099B beschrieben worden.
-
Zusammenfassung
der Erfindung
-
Es
werden Verfahren und Vorrichtungen, die auf Norbornen basierende
Polymersubstrate verwenden, zur Durchführung der Kapillarelektrophorese
bereitgestellt. Im Wesentlichen gesättigte neutrale Poly(Norbornen)-Homo-
und -Copolymere werden als Substrate verwendet, in denen Mikrokanäle gebildet
werden, in denen Ionen unter dem Einfluss eines elektrischen Feldes
bewegt werden. Verbesserte Auftrennungen und Auflösungen von
Gemischen, insbesondere von Nucleinsäuregemischen, werden unter
vergleichbaren Bedingungen im Vergleich zur Verwendung anderer Mikrokanaloberflächen erreicht,
ohne dass eine Vorbehandlung der Oberfläche zur Vermeidung von EOF
notwendig ist.
-
Kurze Beschreibung
der Abbildungen
-
1 ist
ein Elektropherogramm einer DNA-Auftrennung einer DNA-Leiter auf
einem reinen PMMA-Chip und eine graphische Darstellung der Auftrennungsintervalle
(Crossover-Plot).
-
2 ist
ein Elektropherogramm einer DNA-Auftrennung einer DNA-Leiter auf
einem reinen auf Norbornen basierenden Polymer-Chip und eine graphische
Darstellung der Auftrennungsintervalle (Crossover-Plot).
-
3 zeigt
die Ergebnisse der anfänglichen,
aufeinander folgenden DNA-Auftrennungen
einer DNA-Leiter, durchgeführt
auf einem PMMA-Chip unter Verwendung von 2,4% LPA, 1 × TTE und
7 M Harnstoff.
-
4 zeigt
die Ergebnisse der anfänglichen,
aufeinander folgenden DNA-Auftrennungen
einer DNA-Leiter, durchgeführt
auf einem auf Norbornen basierenden Polymer-Chip unter Verwendung
von 2,4% LPA, 1 × TTE
und 7 M Harnstoff.
-
5 ist
eine diagrammatische Ansicht eines Mikrofluid-Kanalmusters; 5b ist
ein Querschnitt eines Kanals.
-
6 ist
ein Kreuzungspunkt-Plot zur Auftrennung einer DNA-Leiter auf einem
Glas-Mikrochip unter Verwendung
einer auskleidenden Zusammensetzung.
-
7 ist
ein Kreuzungspunkt-Plot zur Auftrennung einer DNA-Leiter auf einem
auf Norbornen basierenden Polymer-Mikrochip unter Verwendung der
gleichen auskleidenden Zusammensetzung, die für den Glas-Mikrochip verwendet
wurde.
-
Beschreibung
der einzelnen Ausführungsformen
-
Es
werden Verfahren und Vorrichtungen zur Durchführung elektrophoretischer Auftrennungen
geliefert, die Mikrokanäle
mit einem neutralen hydrogenierten Poly(Norbomen)-Homo- oder -Copolymer
verwenden. Zweckmäßigerweise
wird ein Substrat verwendet, das das Polymer umfasst, wobei in dem
Substrat die Mikrokanäle
und andere Merkmale aus gebildet werden. Diese Verfahren und Vorrichtungen
erlauben Auftrennung von Analyten mit erhöhter Auflösung, insbesondere von Nucleinsäuregemischen,
ohne dass Oberflächenmodifikation
oder Zugabe von Agenzien zur Reduktion des Ausmaßes an EOF notwendig sind.
Die Polymere können
hergestellt werden, indem auf Norbornen basierende Monomermoleküle verwendet
werden, die durch eine Ringöffnungs-Metathesepolymerisation
(ROMP) mit anschließender
Hydrogenierung polymerisiert werden. Die Polymere bestehen im Wesentlichen
vollständig
aus Kohlenwasserstoff, sind allgemein weniger als etwa 5% ungesättigt (basierend
auf der Anzahl der Doppelbindungen, die vor der Hydrogenierung vorliegen)
und weise Hitzebeständigkeit
auf, sie haben ein Tg von mehr als etwa
60°C, normalerweise
mehr als etwa 90°C.
Comonomere umschließen
substituierte Norbornen-modifizierte Monomere, besonders alkylsubstituierte
Norbornen und polyzyklische Verbindungen, 1-Olefine von etwa 2 bis
10 Kohlenstoffatomen etc.
-
Durch
die auf Norbornen basierenden Polymere soll erreicht werden, dass
das Polymer mindestens etwa 10 Mol% eines Norbornenmonomers enthält, besonders
wenn das Polymer unter Verwendung der Ringöffnungs-Metathesepolymerisation
(ROMP) mit anschließender
Hydrogenierung gebildet wird, um verfügbare ungesättigte Bindungen zu reduzieren.
Es ist wünschenswert,
dass das auf Norbornen basierende Polymer aus Monomeren besteht,
die Norbornen und substituierte Norbornen enthalten.
-
Das
Norbornenmonomer wird gewöhnlich
mindestens etwa 20 Mol%, noch gewöhnlicher mindestens etwa 50
Mol%, häufig
mindestens etwa 75 Mol% des Copolymers ausmachen. Die intrinsische
Viskosität
des Polymers wird mindestens etwa 0,5 dl/g betragen (ermittelt in
Toluol bei 25°C).
Die Polymere können
auf herkömmliche
Weisen hergestellt werden, eine Reihe von Homo- und Copolymeren
sind käuflich
zu erwerben. Vgl. zum Beispiel US-Patent Nr. 5,191,026. Gewöhnlich werden
die Polymere, die für
die Mikrokanaloberfläche oder
das Substrat für
die Mikrokanäle
verwendet werden, mittels der Ringöffnungs-Metathese (ROMP) von Norbornen
oder Norbornenderivaten hergestellt. Die Metathesereaktionen sind
auf dem Fachgebiet bekannt, Beispiele werden in den US-Patenten
Nr. 4,945,135; 5,198,511; 5,312,940 und 5,342,909 gegeben. Nach
der Polymerisation werden die Doppelbindungen der Hauptpolymerketten
und der Substituenten im Wesentlichen durch Hydrogenierung gesättigt. Vgl.
Hashimoto, M., Synthesis and Properties of Hydrogenated Ring Opening Metathesis
Polymer, Polymeric Materials: Science and Engineering, American
Chemical Society, Bd. 76, S. 61. Das betreffende Kanaloberflächenmaterial
ist amorph, wasserunlöslich,
nicht porös,
nicht polar (elektrisch neutral) und elektrisch nicht leitend, d.h.
es hat einen hohen elektrischen Widerstand. Das Material ist stabil, indem
es ausreichende mechanische Stärke
und Steifigkeit aufweist, um seine Gestalt unter den notwendigen Bedingungen
für chemische
Prozesse zu behalten, etwa jenen, die für die Kapillarelekrtophorese
notwendig sind, d.h. Salz enthaltene wässrige Medien, in denen der
pH-Wert von 2 bis 12 reichen kann. Die Polymere sind thermoplastisch
und zur Präzisionsformung
oder Formung mit herkömmlichen
Formungs- und Extrusionsverfahren geeignet. Netzbasierende Filmherstellung
ist ebenfalls möglich,
wobei das betreffende Polymer in ein Laminat ausgezogen wird, das
die betreffenden Mikrokanäle
enthält.
Vgl. zum Beispiel Patent WO 99/19717. Die hergestellten Filme werden
allgemein eine Dicke im Bereich von etwa 25 μ bis 1000 μ, noch gewöhnlicher im Bereich von 25 μ bis etwa
75 μ aufweisen.
-
In
den meisten Fällen
umfasst das betreffende Material ein oder mehrere verschiedene Monomere, wobei
einzelne Monomereinheiten im Verlauf der Kette variieren können, abhängig davon,
ob das Polymer ein Homo- oder Copolymer ist, wobei das Polymer mindestens
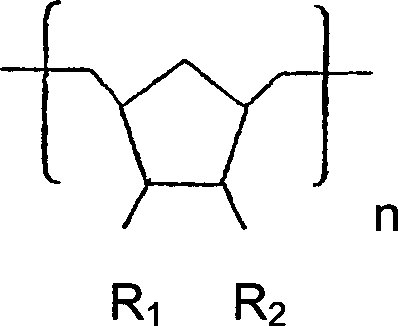
etwa 50 Mol% Monomere der chemischen Formel
umfassen wird, worin R1 und
R2 Wasserstoff-, Alkylreste mit 1 bis 12, gewöhnlich 1 bis 6 Kohlenstoffatomen sind
oder zusammen genommen werden, um einen Ring mit den Kohlenstoffatomen
zu bilden, an die sie gebunden sind, wobei die Ringstruktur mono-
oder polyzyklisch sein kann und einschließlich der Kohlenstoffatome,
an die sie gebunden sind, zwischen etwa 5 bis 12, gewöhnlich zwischen
etwa 5 bis 10 Kohlenstoffatome aufweisen wird, und substituiert
oder nicht substituiert sein kann, besonders von den 1 bis 2 Alkylsubstituenten von
den etwa 1 bis 6 Kohlenstoffatomen.
-
Von
besonderem Interesse sind auf Norbornen basierende Copolymere und
wenigstens eine der Verbindungen Dicyclopentadien (DCP), Tetracyclododecen
(TCD), 4,7-Methan-2,3,3a,4,7,7a-Hexahydroinden (HDCP) oder Dihydrodicyclopentadien,
1,4-Methan-1,4,4a,9a-Tetrahydrofluoren (MTF) und die Alkyl-substituierten
Derivate hiervon, besonders wenn sie von 0–2 Alkylgruppen von 1 bis 6,
gewöhnlich
1 bis 3 Kohlenstoffatomen aufweisen.
-
Die
gewünschten
Eigenschaften und Gesamtqualitäten
der für
die Mikrokanäle
verwendeten Polymere können
mit Hilfe von Variationen bei der Auswahl und dem Verhältnis der
monomeren Einheiten beeinflusst werden. Vgl. Hashimoto, M., Synthesis
and Properties of Hydrogenated Ring Opening Metathesis Polymer, Polymeric
Materials: Science and Engineering, American Chemical Society, Bd.
76, S. 61. Zum Beispiel ist es bei vielen Mikrofluid-Anwendungen
wünschenswert,
Kanäle
in einem Lab-Chip oder Substrat zu haben, die eine Resistenz gegen
Hitze aufweisen. Daher werden die Polymere einen guten Lösungswiderstand
gegen organische Lösungsmittel,
Lichtdurchlässigkeit
bei einer Dicke von 3 mm (ASTM D1003) von mehr als etwa 90% bei
350 nm und darüber,
geringe Wasserabsorption von < 0,01
(ASTM D570) aufweisen; geringe Autofluoreszenz haben, gewöhnlich weniger
als 30%, noch gewöhnlicher
weniger als etwa 20% des kleinsten nachzuweisenden Signals; kompatibel
mit herkömmlichen
Auftrennungsmedien bei geringer Absorption der Medien sein; benetzbar
mit wässrigen
Salzlösungen
unter den Bedingungen der Kapillarelektrophorese und geeignet für Formung
und Extrusion unter Beibehaltung der eingeführten Merkmale sein. Käuflich zu
erwerbende Versionen der betreffenden (Co)polymere umschließen die
Zeonor®- und Zeonex®-
Polymerserien von Nippon Zeon; die Accord®-Polymere
von BF Goodrich; die Topas®-Polymere von Ticona und
die Arton®-Polymere
von JSR. Für
eine Beschreibung einiger dieser Polymere vgl. zum Beispiel Schut,
J.H., New Cyclic Olefins are Clearly Worth a Look, Plastic Technology,
Bd. 46, Nr.3, März
2000, S. 44.
-
Die
betreffenden Mikrokanäle
der elektrophoretischen Vorrichtung werden allgemein innere Querschnittsmaße im Mikrobereich
haben, sodass die unabhängigen
Maße größer als
etwa 1 μm
und kleiner als etwa 1000 μm
sind. Diese unabhängigen
Querschnittsmaße,
d.h. Weite, Tiefe oder Durchmesser, reichen abhängig von der jeweiligen Art
des Kanals allgemein von etwa 1 bis 200 μm, gewöhnlich von etwa 10 bis 150 μm, noch gewöhnlicher
von etwa 20 bis 100 μm,
wobei die gesamte innere Querschnittsfläche im Bereich von etwa 100
bis 40.000 μm2, gewöhnlich
von etwa 200 bis 25.000 μm2 liegt. Die innere Querschnittsform des
Kanals kann zwischen einer Reihe unterschiedlicher Konfigurationen
variieren, einschließlich
rechteckiger, quadratischer, rhombischer, dreieckiger oder V-förmiger,
runder, halbrunder ellipsoider Form und dergleichen.
-
Die
betreffenden Mikrofluid-Vorrichtungen werden allgemein mindestens
zwei Schichten haben, wobei die Schichten zwei Filme, ein dickeres
Substrat und ein Film, eine Vielzahl von Schichten oder Laminaten
sein können,
aus denen die Mikrokanäle
und andere Merkmale, z.B. Reservoirs, in eine Schicht geschnitten,
geprägt,
geformt etc. werden können,
und die andere(n) Schichten) verwendet wird (werden), um Zugänge zu liefern,
Teile der Merkmale einzuschließen
etc. Die einzelnen Schichten können
durch Erhitzen, Adhäsionsmittel,
thermische Bindung oder andere herkömmliche Mittel miteinander
verbunden werden. Gewöhnlich
werden die Vorrichtungen hergestellt, indem ein Substrat mit den
jeweiligen im Substrat vorliegenden Merkmalen geformt und dann eine
Deckschicht aufgebracht wird, um die Mikrokanäle einzuschließen, wobei
der Zugang zu den Reservoirs während
des Formungsverfahrens oder durch die Deckschicht hergestellt wird.
-
Die
Lab-Chips können
kleine Abmessungen im Bereich von etwa 0,5 bis 5 cm und große Abmessungen
von etwa 1 bis 50 cm haben und eine oder eine Vielzahl von einzelnen
elektrophoretischen Einheiten tragen, wobei jede einzelne Einheit
mindestens 3 Reservoirs und zwei verbindende Kanäle aufweisen wird. Die betreffenden
Kanäle
können
gewunden, geradlinig, verzweigt oder in anderer herkömmlicher
Netzwerkweise vorliegen. Mit einem verzweigten Netzwerk ist es möglich, einen
oder mehrere Hauptkanäle
für Analyse-
oder Trennverfahren zu haben, die von einem oder mehreren Injektionskanälen unterteilt
werden. Im Hinblick auf die Hauptkanäle für die Analyse- oder Trennverfahren
gibt es gewöhnlich
eine Nachweiszone, die allgemein für Bestrahlung zugänglich ist.
Die Lage dieser Nachweiszone entlang der Länge des betreffenden Kanals
ist abhängig
von der Anwendung, für
die der Kanal genutzt werden soll. Zum Beispiel ist bei der DNA-Sequenzierung ein
langer elektrophoretischer Separationskanal erforderlich, um eine
gute Auflösung
von endständigen Nucleotiden
in langen DNA-Fragmenten zu erreichen. Bei einer solchen Anwendung
wird die Nachweiszone am Ende oder in Endnähe eines Auftrennungskanals
liegen, der eine Länge
von bis zu 18 cm haben kann. Bei anderen Anwendungsformen wie etwa
Enzymtests ist eine Nachweiszone in Endnähe eines langen Analysekanals
im Allgemeinen nicht erforderlich. Zu allgemeinen Beispielen für Mikrokanäle, Kanalnetzwerke,
Mikrofluid-Chips und ihre Anwendung vgl. US-Patente Nr. 5,750,015,
5,858,188, 5,599,432 und 5,942,443 und WO96/04547.
-
Auf
Norbornen basierendes Polymer wird zumindest das Substrat liefern,
in dem die Merkmale wie die Mikrokanäle und die Reservoirs geformt
werden. Die Mikrokanäle
können
dann eingeschlossen werden, und der Boden der Reservoirs kann von
einem auf Norbornen basierenden Polymer gebildet werden, das die
selbe oder eine andere Zusammensetzung wie das Substrat hat, wobei
die einschließende
Schicht mit Hilfe herkömmlicher
Mittel anlagert wird. Das Substrat kann geformt oder auf andere
Weise gebildet werden, um eine Vielzahl von einzelnen Mikrofluid-Einheiten
zu bilden, wobei jede einzelne Einheit von den anderen Einheiten isoliert
oder mit diesen verbunden sein kann.
-
Die
betreffenden Polymerzusammensetzungen können in einem Sandwich-Format
verwendet werden, um die Mikrofluid-Vorrichtungen herzustellen.
Ein Substrat kann geformt werden, wobei die gewünschten Merkmale wie etwa Reservoirs
und Mikrokanäle
eingefügt
werden. Die Reservoiröffnung
würde sich
durch das gesamte Substrat erstrecken, während sich die Mikrokanäle nur durch
einen Teil der Substratdicke erstrecken würden. Eine dünne Schicht
der betreffenden Polymerzusammensetzung, die eine geringere Glasübergangstemperatur
vom Substrat aufweist, würde
dann aufgebracht, gefolgt von einer dritten Schicht, die dazu dient, die
Mikrokanäle
und eine Seite des Reservoirs einzuschließen, so dass die einschließende Schicht
keinerlei Strukturmerkmale zu haben braucht. Bei Kompression des
Sandwich bei oder in der Nähe
der Glasübergangstemperatur
der mittleren Schicht wird eine starke adhärente Bindung zwischen den
Schichten erreicht, wobei die Natur der Oberfläche der Mikrokanäle immer
noch erhalten bleibt. Allgemein wird der Unterschied der Glasübergangstemperatur
zwischen der mittleren Schicht und den anderen beiden Schichten
mindestens etwa 10°C,
noch gewöhnlicher
mindestens etwa 25°C
und nicht mehr als etwa 50°C
betragen. Wie vorstehend genannt, können auch andere Techniken
verwendet werden, um die Mikrofluid-Vorrichtungen herzustellen.
-
Die
betreffenden Mikrofluid-Vorrichtungen brauchen keine weiteren Zusätze als
die, die bei herkömmlicher
Weise zur Auftrennung verwendet werden. Das heißt, in vielen Fällen, dass
ein Siebmedium verwendet wird, besonders wenn die zu trennenden
Ionen im Wesentlichen die gleichen Masse/Ladungs-Verhältnisse aufweisen,
wie es bei Nucleinsäuren
beobachtet wird. Selbst wenn unterschiedliche Masse/Ladungs-Verhältnisse
im Analyt vorliegen, ist es häufig
wünschenswert,
einen polymeren Zusatz im Medium in den Kanälen zu haben, um die Auftrennung
zu verbessern. In den meisten Fällen
werden die Polymere polar und stabil dispergierbar in wässrigen
Medien, gewöhnlich
löslich
in wässrigem
Medium sein und Monomere einschließlich Sauerstoff, Stickstoff
etc. enthalten, wobei die funktionalen Gruppen Oxy- (Ether- und
Hydroxyl-) Gruppen, Nicht-Oxo-Carbonyl– (Ester- und Amid-) Gruppen
etc. sind.
-
Von
besonderem Interesse ist die elektrophoretische Auftrennung von
komplexen Gemischen großer Anzahlen
von unterschiedlich großen
Nucleinsäuren
wie DNA-Fragmenten,
die für
Sequenzierungen umfangreicher Genome oder für die Analyse einzelner Nucleotid-Polymorphismen
erzeugt werden. Von besonderem Interesse ist die Auftrennung von
ss- oder dsDNA-Fragmenten mit Strängen, deren Größe von etwa
10 bis 10.000.000 Basen, gewöhnlich
von etwa 10 bis 10.000 Basen, noch gewöhnlicher von etwa 10 bis 5.000
Basen reicht. Verfahren für
DNA-Nachweis und -.Sequenzierung, die Mikrokanäle verwenden, werden ausführlich von
Barron & Blach
und Lipshutz & Fodor,
Curr. Opinion in Struct. Biol. (1994) 4: 3 76–380) beschrieben.
-
Zur
Sequenzierung von DNA werden gewöhnlich
die Verfahren von Sänger
oder Gilbert verwendet. Diese Verfahren beinhalten die Verwendung
der Ziel-DNA als eine Matrize und die Erweiterung eines Primers in
Anwesenheit eines terminierenden markierten Nucleotids, z.B. eines
fluoreszierend markierten Didesoxynucleotids. Durch die unterschiedliche
Markierung der verschiedenen Nucleotide in der Weise, dass man die
unterschiedlichen, terminierenden Nucleotide unterscheiden kann,
wird eine Sequenzleiter produziert, die die Bestimmung der Sequenz
erlaubt. Durch Verwendung der betreffenden Vorrichtungen werden
effektive und wirksame Auftrennungen der einzelnen Fragmente erhalten,
wobei Sequenzen von 400 oder mehr Nucleotiden, besonders mindestens
etwa 500 Nucleotiden in einer einzelnen Bestimmung analysiert werden
können.
Dies wird in den 3 und 4 anhand
von Daten dargestellt, die aus ähnlichen
CE-Auftrennungen stammen, die sowohl mit auf Norbornen basierenden
Polymeren als auch auf PMMA durchgeführt wurden, wobei gezeigt worden
ist, dass letztere erfolgreich in der Elektrophorese verwendet worden
ist. Vgl. zum Beispiel US-Patent Nr. 6,054,034. Aus diesem Vergleich
ist klar ersichtlich, dass verbesserte Auflösung und Wirksamkeit durch
die Verwendung von Polymer-Mikrokanälen auf Norbornenbasis erreicht
werden kann.
-
Bei
der Durchführung
chemischer Auftrennungen werden die betreffenden Mikrokanäle zuvor
mit Trennmedien beschickt, gewöhnlich
unter Druck. Beispiele herkömmlicher
Trennmedien umschließen
Polyacrylamide, Hydroxyethylcellulose (MG 50 kDa bis 1000 kDa),
Agarose, Dextran, Polyethylenglycol (20 kDa bis 200 kDa), Poly-N-acryloyl-Tris
(polyNAT), Poly-AAEE (Poly-N-acryloylaminoethoxyethanol),
PEO (Polyethylenoxid) und dergleichen. Geeignete Pufferlösungen können ebenfalls
verwendet werden. Vgl. zum Beispiel US-Patent Nr. 5,120,413. Probeninjektion
und Verwendung von Mikrokanälen
für die
Elektrophorese werden allgemein in dem US-Patent Nr. 6,054,034 beschrieben.
Die Standardbedingungen können
entsprechend der jeweilig gewünschten
Anwendung variieren. Nucleinsäuren
werden für
die Elektrophorese allgemein mit des hydrophilen Trennmedien vorgefertigt,
deren Konzentration höher
als ihre Verhaftungsschwelle ist, da DNA-Fragmente mit unterschiedlicher
Länge alle
das gleiche Verhältnis
von Masse zu elektrischer Ladung haben und das molekulare Sieben
der Mechanismus ist, um diesen Unterschied aufzulösen. Die
elektrische Feldstärke
liegt im Bereich von 50–1000
V/cm, meistens zwischen 100–200
V/cm. Die Temperatur zur Durchführung
der DNA-Auftrennung liegt im Bereich von 20-80°C,
meistens zwischen 50 und 60°C.
Die gewöhnlichen Puffersysteme
sind Tris-TAPS-EDTA,
Tris-Borat-EDTA, und Natrium-TAPS-Pufferlösung bei einem pH-Wert von
~8,3. Bei der Elekrophorese von kleinen Ionen werden hydrophile
Trennmedien der Pufferlösung
in einer viel geringeren Konzentration zugegeben, normalerweise
geringer als ihre Verknüpfungsschwelle,
um die Viskosität
dieses Puffersystems zu erhöhen
und hydrodynamisches Fließen
innerhalb der Kanäle
zu vermeiden. Das Verhältnis
von Masse zu elektrischer Ladung ist bei den kleinen Analyten immer
noch die Basis des Trennverfahrens. Die Feldstärke des Trennverfahrens liegt
zwischen 50–2000
V/cm, normalerweise zwischen 100 und 300 V/cm. Bei Durchmusterungsuntersuchungen
mit hohem Durchsatz wird ein PEO-Polymer mit geringerem Molekulargewicht
zu Trennmedien wie etwa 25 mM HEPES-Pufferlösung zugegeben. Ein Polymer
mit nicht ionischen und hydrophilen Eigenschaften wird normalerweise
in diesem Fall bevorzugt, ist aber nicht immer notwendig.
-
Die
betreffenden Vorrichtungen, bei denen die auf Norbornen basierenden
Polymere verwendet werden, liefern ausgezeichnete Auftrennungsergebnisse.
Die betreffenden Vorrichtungen liefern verstärkte Auftrennungen von Probenbestandteilen,
sie finden besondere Anwendung bei DNA-Sequenzierung mit herkömmlichen
Trennmedien und erlauben verbesserte Auftrennungen über einen
weiteren Bereich von Fragmentgrößen.
-
Die
nachstehenden Beispiele sind zur Erläuterung und nicht zur Begrenzung
angeführt.
-
Experimente
-
Sequenzierung von Nucleinsäure
-
Chip-Layout
-
Die
in diesem Experiment verwendeten Plastik-Mikrochips wurden durch
Heißprägung mit
einem Nickel-Elektroformungs-Bezugformstück, das die gewünschte Elektrophoresestruktur
enthielt, hergestellt. Die Elektrophoresevorrichtung umschließt einen
Doppel-T-Injektor und einen Hauptmikrokanal zur Auftrennung, wie
in 5 dargestellt. Die Vorrichtung 100 ist
als Diagramm abgebildet, worin Linien die Kanäle und Kreise die Reservoirs
anzeigen. Das Probenreservoir ist mit dem analytischen Kanal 104 über den
Seitenkanal 106 verbunden, während das Reservoir für Probenabfall
mit dem analytischen Kanal 104 über einen zweiten Seitenkanal 110 verbunden
ist. Das Probenreservoir 102 und das Abfallreservoir 108 mit
ihren angeschlossenen Seitenkanälen 106 und 110 dienen
dazu, die Probe in den analytischen Kanal 104 zu injizieren.
Der Doppel-T-Injektor hatte eine Öffnung von 250 μm, die sich
mit dem analytischen Kanal 104 schnitt. Das Pufferreservoir 112 und
das Abfallreservoir befinden sich an gegenüberliegenden Enden des analytischen
Kanals 104. Der Querschnitt des analytischen Kanals 104 ist
in 5b dargestellt. Die Entfernung vom Zentrum des
Injektors zum Nachweispunkt betrug etwa 18 cm. Die vier angeschlossenen
Reservoirs, die Pufferlösung 112,
Pufferlösung
für Probenabfall 108,
Abfallpufferlösung 114 und
Probe 102 enthielten, hatten einen Durchmesser von etwa
1,5 mm. Abgesehen vom Abfallreservoir 114 lagen die anderen
Reservoirs 4 mm vom Doppel-T-Injektorschnittpunkt entfernt. In jedem
der Reservoirs wurden Elektroden (nicht abgebildet) zur automatischen Kontrolle
der Feldstärke
platziert. Die Plastik-Mikrochips wurden aus Poly(methylmethacrylat)
(PMMA) oder Zeonor 1420R (Nippon Zeon Co., Ltd., Kawasaki, Japan)
hergestellt. Die Mikrochips aus Poly(methylmethacrylat) werden aus
im Hause verwendeten Materialien hergestellt, und es zeigte sich,
dass sie gute Auftrennungsergebnisse lieferten, wenn geeignete Oberflächenmodifikationen
oder Zusätze
verwendet wurden. (Vgl. McCormick, et al. Anal. Chem. 1997, 69,
2626–2630,
aus dem Labor des Rechtsnachfolgers der vorliegenden Erfindung;
und Soper, et al., Journal of Chromatography A, 833 (1999) 107–120.)
-
Herstellung
von LPA-Trennmedien
-
Die
Polymerisation wurde mit leichten Veränderungen nach dem in Eur.
Polym. 1 1984, 20, 505–512 beschrieben
Protokoll durchgeführt.
In einem Pyrex-Reaktionsgefäß wurde
eine 40%ige (Gew./Gew.) Acrylamid-Lösung in einer Lösung aus
2,4% SPAN 80 in Spezialpetroleum auf ein Volumenverhältnis von
1:1 dispergiert. APDS und TEMED wurden zur Katalyse der Reaktion
verwendet, beide in einer Endkonzentration von 0,0055 Gew./Vol.
Um Sauerstoff zu entfernen, wurde die gesamte Dispersion kontinuierlich
mit Stickstoff gereinigt, und die Polymerisationsreaktion wurde
dann bei 350°C über Nacht
durchgeführt.
Aceton wurde verwendet, um das Polyacrylamid auszufällen. Der
Niederschlag wurde mehrere Male mit Aceton auf einem Buechner-Trichter
gewaschen und restliches Lösungsmittel
wurde unter durch Ölpumpe
erzeugtes Vakuum auf einem Rotationsevaporator entfernt. Um 2%ige
LPA-Matrix-Lösung
zur DNA-Sequenzierung
herzustellen, wurden das getrocknete Polymer, Harnstoff, Pufferlösungskonzentrat
und Wasser zu den gewünschten
Endkonzentrationen in einem Glastopf zusammengegeben und dann langsam
mit Hilfe eines Magnetrührers
gerührt.
-
Herstellung des hydrophoben
LDD30-Copolymers
-
Das
LDD30-Polymer ist ein nicht-quervernetztes Polymer, das durch Polymerisation
in Lösung
mit freien Radikalen synthetisiert wird. Die Polymerisation wird
in einer wässrigen
Lösung
der Monomere Diethylacrylamid und Dimethylacrylamid (70:30) durchgeführt. Die
Gesamtkonzentration der Monomere beträgt etwa 10% oder weniger (Gew./Vol.)
Die Lösung
wird vor der Synthese durch sprudelndes Argon, Helium oder sprudelnden
Stickstoff entgast. Die Polymerisationsreaktion wird durch die Zugabe
von Ammoniumpersulfat und TEMED (Tetramethylethylendiamin) gestartet.
Diese Lösung
wird der Dialyse gegen gereinigtes Wasser unterzogen und gefriergetrocknet,
um nicht umgesetzte Monomere zu entfernen und das Polymer in fester
Form zu erhalten.
-
LDD30
ist eine Verbindung, die als bestehend aus 30 Gewichts-% Diethylacrylamid,
70 Gewichts-% Dimethylacrylamid definiert ist, wobei die Prozentangaben
als ein Prozentsatz der Gesamtmasse der Monomere in der Lösung vor
der Polymerisation angegeben werden. Es stellte sich heraus, dass
diese Verbindung erwünschte
Auftrennungs- und Auskleidungseigenschaften aufweist. Polymere mit
anderen Verhältnissen
der beiden Monomere können
nützlich
sein, abhängig
von den Erfordernissen der jeweiligen Durchführung. Das Ausmaß der Aufnahme
jedes einzelnen Monomers in das entstehende Polymer ist nicht untersucht
worden.
-
GeneScan 700-DNA-Leiter
-
Die
GeneScan 700-DNA-Leiter ist ein Satz von speziell hergestellten
DNA-Fragmenten,
die mit einem fluoreszierenden Farbstoff markiert sind (TET, 6-carboxy-4,7,2',7'-Tetrachlorfluorescein,
Emissionswellenlänge:
540 nm; Anregungswellenlänge:
520 nm). GeneScan 700 enthält
20 Fragmente, einschließlich
35 Bp, 50 Bp, 75 Bp, 100 Bp, 139 Bp, 150 Bp, 160 Bp, 200 Bp, 250
Bp, 300 Bp, 340 Bp, 350 Bp, 400 Bp, 450 Bp, 490 Bp, 500 Bp, 550
Bp, 600 Bp, 650 Bp und 700 Bp. Unter der verwendeten experimentellen
Vorgabe wurden nur 18 Fragmente beobachtet, was das 35 Bp- und 50
Bp-Fragment sind aufgrund der Interferenz von kleinen fluoreszierenden
Fragmenten, die in diesem Bereich zusammen wandern, ausschließt. Die
einzufüllende
Probe wurde mit 5 μ GeneScan
700, 5 μl
deionisiertem Wasser und 10 μl
deionisiertem Formamid hergestellt. Die einzufüllende Probe wurde darauf bei
95°C über 2 Minuten
denaturiert, bevor sie in einem Eisbad abgeschreckt wurde.
-
Auftrennungsbedingungen
-
LPA,
das vorstehend genannte hydrophile Trennmedium, wurde vom Abfallreservoir
für Pufferlösung (114)
eingefüllt,
indem ein Druck von 150 bis 200 psi über 2 bis 5 Minuten aufgebaut
wurde. Nach der entsprechenden Füllung
der übrigen
Reservoirs mit Proben- und Pufferlösung wurde der gesamte Mikrochip
auf einer Thermostation platziert und auf 35°C erwärmt. Eine Peltier-Vorrichtung
kontrollierte die Thermostation thermisch. Es wurde ein herkömmlicher
Fluoreszenznachweis verwendet. Die Datenerhebungsrate betrug etwa
10 Hz, während
ein 488 nm-Ar-Ionenlaser
mit einer Laserstärke
von etwa 7 mW verwendet wurde. Die Trennfeldstärke betrug etwa 150 V/cm. Die
Spannungsanordnung ist in der nachstehenden Tabelle aufgelistet:
-
-
Kreuzungspunkt-Plot zur
Datenanalyse
-
Kreuzungspunkt-Plots
von Peak-Intervall und Peak-Breite wurden gegen DNA-Fragmentgröße aufgetragen.
Diese Plots werden in den 1 und 2 widergegeben.
Das Peak-Intervall ist die räumliche
Distanz zwischen zwei DNA-Fragmenten,
die sich nur durch ein Nucleotid in der Länge unterscheiden. Die Peak-Breite ist die volle
Breite an der Stelle des halben Peak-Maximums (FWHM). Der Punkt,
an dem sich die beiden Linien überkreuzen,
bezeichnet die Grenze der Auftrennung für die Auflösung einzelner Basen und entspricht
einem Auflösungswert
von 0,59. Die Peak-Breiten wurden mit den Blauen Kanälen bei
einer Wellenlänge
von 515–530
nm gemessen. Die Peak-Breiten wurden an ein Polynom zweiter Ordnung
angenähert.
Die Basislinie der Daten wurde ermittelt, und sie wurden mit einer
Kreuzungspunkt-Bearbeitungssoftware von PE-Biosystems analysiert.
-
Es
wurde auch ein Vergleich unter Verwendung von Glas-Chips gemacht,
bei dem ein auskleidendes Polymer, LDD30, verwendet wurde. Glas
liefert in Abwesenheit eines auskleidenden Polymers keine sinnvolle Auftrennung.
Die Auftrennung wurde bei 40°C
mit einer effektiven Trennfeldstärke
von 150 V/cm durchgeführt.
-
REPRÄSENTATIVE
DATEN
-
DNA-Auftrennung
auf einem PMMA-Chip
-
DNA-Auftrennung
wurde auf einem im Hause hergestellten Sandwich-Chip (vgl. zum Beispiel
Song, et al., Electrophoresis 1999, 20:2847–2855 als eine Beschreibung
der Verwendung von PMMA als einem Material für Mikrofluidvorrichtungen,
die eine Auskleidung aus nicht-ionischen grenzflächenaktiven Substanzen verwenden
bei 150V/cm und 35°C,
2% Hochmolekulargewichts-LPA in 1 × TTE (1 × TTE = 50 mM Tris; 50 mM TAPS
und 2 mM EDTA, pH-Wert 8,2) durchgeführt, und 7 M Harnstofflösung wurde
verwendet, um GeneScan 700-DNA-Leitern aufzutrennen. Viele aufeinander
folgende Durchläufe
wurden durchgeführt.
Unabhängig
von der Behandlung und Reinigung der Kanaloberflächen lag der Kreuzungspunkt
niemals höher
als 300 Basen. 1 zeigt die Auftrennung der
GeneScan 700-Leiter auf den Sandwich-Chips und den zugehörigen Kreuzungspunkt-Plot.
In diesem Fall liegt der Kreuzungspunkt bei 250 Bp. Dies legt nahe,
dass das Rest-EOF der PMMA-Oberfläche relativ
hoch ist, obwohl die Viskosität
der Siebmatrix hoch ist, und die Verschlechterung der Auflösung der
DNA-Auftrennung verursachen kann. Dies steht im Einklang mit der
Tatsache, dass in zahlreichen Untersuchungen adäquate Auflösungen (dicht an 500 Bp) ohne
die Verwendung von nicht-herkömmlichen
Trenn-Polymeren oder Vorbehandlung der Oberflächen nicht erreicht werden
kann.
-
DNA-Auftrennung
auf Zeonor-Chip
-
Die
Auftrennung der gleichen Probe (GeneScan 700-Leiter, markiert mit
TET) wurde auf einem Zeonor-Sandwich-Chip durchgeführt, hergestellt
aus einer Z1420R/Z1020R/Z1420R -Kombination, wobei die Schichten
thermisch zusammengepresst wurden und die Z1020R-Zusammensetzung
eine niedrigere Glas-Durchgangstemperatur hat, um als die adhärente Schicht
zu dienen. Die beiden äußeren Schichten
waren 1 mm dick, wobei die Zwischenschicht eine Dicke im Bereich
von 50 – 100 μm hatte.
In eine der äußeren Schichten
wurde die Kanalform geprägt,
indem eine Vorlage verwendet wurde, um die Struktur in die Schicht einzudrücken. Die
gleiche 2%ige LPA-Lösung
in 1 × TTE
und 7 M Harnstoff wurde als Siebmatrix verwendet, und das Experiment
wurde bei 35°C
und 150 V/cm durchgeführt.
Die Ergebnisse werden in 2 dargestell. Nach mehreren
Durchläufen
mit der gleichen Siebmatrixspülung
erreichte die Auftrennung von GeneScan 700 eine Auflösung von
bis zu 525 Bp in Referenz zum Kreuzungspunkt. 4 zeigt
mehrere Elektropherogramme zur DNA-Auftrennung von GeneScan 700
auf Zeonor Sandwich-Chips. Aus diesen Diagrammen wird deutlich, dass
die reine Zeonor-Oberfläche
DNA-Auftrennung bis zu 500 Bp ohne jede Modifikation liefern kann.
-
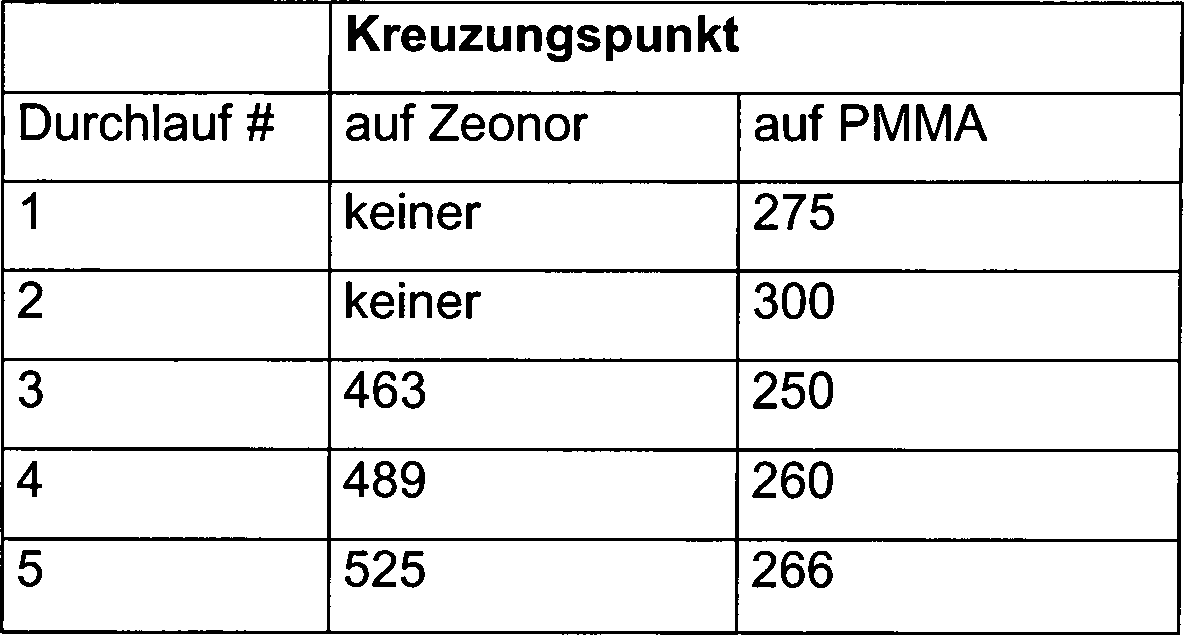
Die
nachstehende Tabelle ist ein Vergleich von aufeinanderfolgenden
Durchläufen
zur DNA-Auftrennung auf den beiden unterschiedlichen Oberflächen von
PMMA und Zeonor. Sie legt nahe, dass die Zeonor-Oberfläche die
Wechselwirkung bei 2%iger LPA-Lösung
liefern kann, so dass sie den EOF reduziert, PMMA dies aber nicht
tut.
-
-
6–7 geben
Kreuzungspunkt-Plots der Ergebnisse mit Glas-Chips und mit auf Norbornen
basierenden Polymer-Chips wider und zeigen, dass in Anwesenheit
des gleichen Oberflächen
auskleidenden Materials der auf Norbornen basierende Polymer-Chip
wesentlich besser als der Glas-Chip in der Auftrennung ist und dass
die Oberflächenauskleidung
mit dem auf Norbornen basierenden Polymer-Chip im Vergleich zum Fehlen
der auskleidenden Verbindung eine kleine Verstärkung der Auftrennung liefert.
-
Aus
den vorstehenden Ergebnissen und der Diskussion wird deutlich, dass
die Polymer-Mikrokanäle im
Sinne der betreffenden Erfindung eine ausgezeichnete Durchführung der
elektrophoretischen Auftrennung von Ionen ermöglichen. Die Oberflächen benötigen keine
Vorbehandlung und das System arbeitet in Anwesenheit herkömmlicher
Siebmedien. Keine speziellen Zusätze
oder Behandlung der Oberfläche
sind notwendig.