DE69835309T2 - Imidazonaphthyridinderivate und ihre verwendung zur induzierung von biosythese von cytokin - Google Patents
Imidazonaphthyridinderivate und ihre verwendung zur induzierung von biosythese von cytokin Download PDFInfo
- Publication number
- DE69835309T2 DE69835309T2 DE69835309T DE69835309T DE69835309T2 DE 69835309 T2 DE69835309 T2 DE 69835309T2 DE 69835309 T DE69835309 T DE 69835309T DE 69835309 T DE69835309 T DE 69835309T DE 69835309 T2 DE69835309 T2 DE 69835309T2
- Authority
- DE
- Germany
- Prior art keywords
- alkyl
- compound
- compounds
- formula
- reaction
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4738—Quinolines; Isoquinolines ortho- or peri-condensed with heterocyclic ring systems
- A61K31/4745—Quinolines; Isoquinolines ortho- or peri-condensed with heterocyclic ring systems condensed with ring systems having nitrogen as a ring hetero atom, e.g. phenantrolines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/02—Nasal agents, e.g. decongestants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/04—Antipruritics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/12—Keratolytics, e.g. wart or anti-corn preparations
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
- A61P31/06—Antibacterial agents for tuberculosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
- A61P31/08—Antibacterial agents for leprosy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/10—Antimycotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
- A61P31/22—Antivirals for DNA viruses for herpes viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
- A61P33/08—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis for Pneumocystis carinii
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/14—Ectoparasiticides, e.g. scabicides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains three hetero rings
- C07D471/14—Ortho-condensed systems
Description
- Diese Erfindung betrifft die Imidazonaphthyridinverbindung 2-Methyl-1-(2-methylpropyl)-1H-imidazo[4,5c][1,5]naphthyridin-4-amin oder pharmazeutisch annehmbare Salze davon. Diese Erfindung betrifft zudem pharmazeutische Zusammensetzungen, die die obigen Imidazonaphthyridinverbindungen enthalten. Ein weiterer Aspekt dieser Erfindung betrifft die Verwendung dieser Verbindungen als Immunmodulatoren und zum Induzieren der Cytokinbiosynthese bei Tieren.
- Der erste vertrauenswürdige Bericht über das 1H-Imidazo[4,5-c]chinolinringsystem, Backman et al. J. Org. Chem. 15, 1278–1284 (1950), beschreibt die Synthese von 1-(6-Methoxy-8-chinolinyl)-2-methyl-1H-imidazo[4,5-c]chinolin zur möglichen Verwendung als Antimalariamittel. Nachfolgend wurde über Synthesen von verschiedenen substituierten 1H-Imidazo[4,5-c]chinolinen berichtet. Jain et al., J. Med. Chem. 11, Seiten 87–92 (1968), synthetisierten beispielsweise die Verbindung 1-[2-(4-Piperidyl)ethyl]-1H-imidazo[4,5-c]chinolin als mögliches Antikonvulsivum und kardiovaskuläres Mittel. Baranov et al., Chem. Abs. 85, 94362 (1976), haben auch über mehrere 2-Oxoimidazo[4,5-c]chinoline berichtet, und Berenyi et al., J. Heterocyclic Chem. 18, 1537–1540 (1981), haben über bestimmte 2-Oxoimidazo[4,5-c]chinoline berichtet.
- Es wurde später gefunden, dass bestimmte 1H-Imidazo[4,5-c]chinolin-4-amine sowie 1- und 2-substituierte Derivate davon als antivirale Mittel, Bronchodilatoren und Immunmodulatoren brauchbar sind. Sie sind unter anderem in US-A-4,689,338; US-A-4,698,348; US-A-4,929,624; US-A-5,037,986; US-A-5,268,376; US-A-5,346,905 und US-A-5,389,640 beschrieben, die hier alle zum Zweck der Bezugnahme zitiert werden. Obwohl es ein fortlaufendes Interesse an dem Imidazochinolinringsystem gibt, wie sich beispielsweise in WO-A-98/30562 zeigt, besteht ein fortlaufender Bedarf an Verbindun gen, die die Fähigkeit zur Modulation der Immunreaktion durch Induktion der die Cytokinbiosynthese oder nach anderen Mechanismen aufweisen.
- Die vorliegende Erfindung betrifft die Verbindung 2-Methyl-1-(2-methylpropyl)-1H-imidazo[4,5,5c][1,5]naphthyridin-4-amin oder ein pharmazeutisch annehmbares Salz davon. Die vorliegende Erfindung liefert zudem eine pharmazeutische Zusammensetzung, die eine pharmazeutisch wirksame Menge der obigen Verbindung oder des obigen Salzes oder einen pharmazeutisch annehmbaren Träger umfasst. Eine weitere Ausführungsform der vorliegenden Erfindung betrifft die obige Verbindung oder das obige Salz zur Verwendung in einem Verfahren zum Induzieren der Cytokinbiosynthese bei einem Tier. Die vorliegende Erfindung betrifft zudem die Verwendung der obigen Verbindung oder des obigen Salzes zur Herstellung eines Medikaments zum Induzieren der Cytokinbiosynthese bei einem Tier. Eine weitere Ausführungsform der vorliegenden Erfindung betrifft die obige Verbindung oder das obige Salz zur Verwendung in einem Verfahren zur Behandlung einer Virusinfektion bei einem Tier. Die vorliegende Erfindung betrifft zudem die Verwendung der obigen Verbindung oder des obigen Salzes zur Herstellung eines Medikaments zur Behandlung einer Virusinfektion bei einem Tier.
- Die erfindungsgemäßen Verbindungen sind als Modifizierungsmittel der Immunreaktion brauchbar, weil sie die Cytokinbiosynthese induzieren können und anderweitig die Immunreaktion modulieren können, wenn sie Tieren verabreicht werden. Diese Fähigkeit macht die Verbindungen zur Behandlung einer Vielfalt von Zuständen brauchbar, z. B. Viruserkrankungen und Tumoren, die auf derartige Veränderungen in der Immunreaktion ansprechen.
-
- – Wasserstoff;
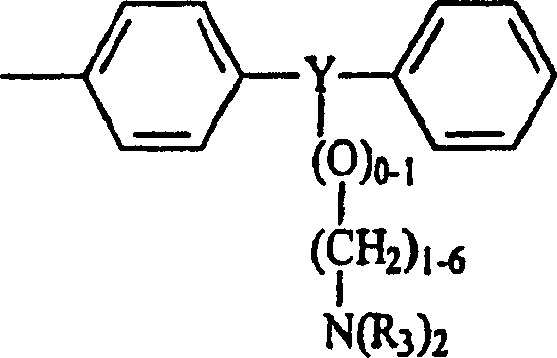
- – C1-20-Alkyl oder C2-20-Alkenyl, das unsubstituiert oder mit einem oder mehreren Substituenten substituiert ist, die ausgewählt sind aus der Gruppe bestehend aus: – Aryl; – Heteroaryl; – Heterocyclyl; – O-C1-20-Alkyl, – O-(C1-20-Alkyl)0-1-aryl; – O-(C1-20-Alkyl)1-0-heteroaryl; – O-(C1-20-Alkyl)0-1-heterocyclyl; – C1-20-Alkoxycarbonyl; – S(O)0-2-C1-20-Alkyl; – S(O)0-2-(C1-20-Alkyl)0-1-aryl; – S(O)0-2-(C1-20-Alkyl)0-1-heteroaryl; – S(O)0-2-(C1-20-Alkyl)0-1-heterocyclyl; – N(R3)2; – N3; – Oxo; – Halogen; – NO2; – H und – SH und – C1-20-Alkyl-NR3-Q-X-R4 oder -C2-20-Alkenyl-NR3-Q-X-R4, wobei Q -CO- oder -SO2- ist; X eine Bindung, -O- oder -NR3- ist und R4 Aryl; Heteroaryl; Heterocyclyl oder -C1-20-Alkyl oder C2-20-Alkenyl ist, die unsubstituiert oder mit einem oder mehreren Substituenten substituiert sind, die ausgewählt sind aus der Gruppe bestehend aus: – Aryl; – Heteroaryl; – Heterocyclyl; – O-C1-20-Alkyl, – O-(C1-20-Alkyl)0-1-aryl; – O-(C1-20-Alkyl)1-0-heteroaryl; – O-(C1-20-Alkyl)0-1-heterocyclyl; – C1-20-Alkoxycarbonyl; – S(O)0-2-C1-20-Alkyl; – S(O)0-2-(C1-20-Alkyl)0-1-aryl; – S(O)0-2-(C1-20-Alkyl)0-1-heteroaryl; – S(O)0-2-(C1-20-Alkyl)0-1-heterocyclyl; – N(R3)2; – NR3-CO-O-C1-20-Alkyl; – N3; – Oxo; – Halogen; – NO2; – OH und – SH, oder R4
- Die Begriffe "Alkyl", "Alkenyl" und die Vorsilbe "-Alk" beinhalten sowohl geradkettige als auch verzweigte Gruppen und cyclische Gruppen, d. h. Cycloalkyl und Cycloalkenyl. Diese cyclischen Gruppe können monocyclisch oder polycyclisch sein und haben vorzugsweise 3 bis 20 Ringkohlenstoffatome. Zu Beispielen für cyclische Gruppen gehören Cyclopropyl, Cyclopentyl, Cyclohexyl und Adamantyl.
- Der Begriff "Aryl" beinhaltet hier carbocyclische aromatische Ringe oder Ringsysteme. Zu Beispielen für Arylgruppen gehören Phenyl, Naphthyl, Biphenyl, Fluorenyl und Indenyl. Der Begriff "Heteroaryl" beinhaltet aromatische Ringe oder Ringsysteme, die mindestens ein Ringheteroatom enthalten (z. B. O, S, N). Zu geeigneten Heteroarylgruppen gehören Furyl, Thienyl, Pyridyl, Chinolinyl, Tetrazolyl, Imidazo und so weiter.
- "Heterocyclyl" beinhaltet nicht-aromatische Ringe oder Ringsysteme, die mindestens ein Ringheteroatom enthalten (z. B. O, S, N). Zu beispielhaften heterocyclischen Gruppen gehören Pyrrolidinyl, Tetrahydrofuranyl, Morpholinyl, Thiazolidinyl und Imidazolidinyl.
- Die Aryl-, Heteroaryl- und Heterocyclylgruppen können unsubstituiert oder mit einem oder mehreren Substituenten substituiert sein, die ausgewählt sind aus der Gruppe bestehend aus C1-20-Alkyl, Hydroxy, Halogen, N(R3)2, NO2, C1-20-Alkoxy, C1-20-Alkylthio, Trihalogenmethyl, C1-10-Acyl, Arylcarbonyl, Heteroarylcarbonyl, (C1-10-Alkyl)0-1-aryl, (C1-10-Alkyl)0-1-Heteroaryl, Nitril, C1-20-Alkoxycarbonyl, Oxo, Arylalkyl, wobei die Alkylgruppe 1 bis 10 Kohlenstoffatome aufweist, und Heteroarylalkyl wobei die Alkylgruppe 1 bis 10 Kohlenstoffatome aufweist.
- Die Erfindung umfasst die Verbindung 2-Methyl-1-(2-methylpropyl)-1H-imidazo[4,5-c][1,5]naphthyridin-4-amin in beliebigen ihrer pharmazeutisch annehmbaren Formen, einschließlich Isomeren wie Enantiomeren, Salzen, Solvaten, Polymorphen und dergleichen.
- HERSTELLUNG DER VERBINDUNGEN
- Verbindungen der Formel I, wobei A =CR-CR=CR-N= ist und R, R1 und R2 wie oben definiert sind, können nach Reaktionsschema III hergestellt werden.
- In Stufe (1) von Reaktionsschema III wird ein 3-Nitro[1,5]naphthyridin-4-ol der Formel XXIX mit einem geeigneten Chlorierungsmittel, wie Phosphoroxychlorid, chloriert, um ein 4-Chlor-3-nitro[1,5]naphthyridin der Formel XXX zu liefern. Die Reaktion kann durchgeführt werden, indem eine Verbindung der Formel XXIX mit Phosphoroxychlorid in einem geeigneten Lösungsmittel, wie N,N-Dimethylformamid, unter gelindem Erwärmen (etwa 55°C) umgesetzt wird. Die Verbindung kann nach konventionellen Verfahren isoliert werden, oder es kann ohne Isolierung weitergearbeitet werden, wie nachfolgend im Zusammenhang mit Stufe (2) beschrieben wird. Die Ver bindung der Formel XXIX, wobei R Wasserstoff ist, ist bekannt, und ihre Herstellung ist in Hart, Journal of the Chemical Society, Seiten 212–214, (1956) offenbart.
- In Stufe (2) von Reaktionsschema III wird ein 4-Chlor-3-nitro[1,5]naphthyridin der Formel XXX mit einem Amin der Formel R1NH2 umgesetzt, wobei R1 wie oben definiert ist, um ein 3-Nitro[1,5]naphthyridin-4-amin der Formel XXXI bereitzustellen. Die Reaktion kann durchgeführt werden, indem Wasser, danach Amin im Überschuss zu der Reaktionsmischung gegeben wird, die aus Stufe (1) resultiert, und danach auf einem Dampfbad erwärmt wird. Die Reaktion kann auch durchgeführt werden, indem Amin im Überschuss zu einer Lösung einer Verbindung der Formel XXX in einem geeigneten Lösungsmittel, wie Dichlormethan, gegeben und gegebenenfalls erwärmt wird. Die Verbindung der Formel XXXI, wobei R1 Wasserstoff ist, ist bekannt, und ihre Herstellung ist in Wozniak et al., J. R. Neth. Chem. Soc. 102 (12), Seiten 511–13 (1983), offenbart.
- In Stufe (3) von Reaktionsschema III wird ein 3-Nitro[1,5]naphthyridin-4-amin der Formel XXXI reduziert, um ein [1,5]-Naphthyridin-3,4-diamin der Formel XXXII zu liefern. Die Reduktion wird vorzugsweise unter Verwendung eines konventionellen heterogenen Hydrierkatalysators durchgeführt, wie Platin auf Kohle oder Palladium auf Kohle. Die Reaktion kann zweckmäßig mit einer Parr-Apparatur in einem geeigneten Lösungsmittel, wie Ethylacetat, durchgeführt werden.
- In Stufe (4) von Reaktionsschema III wird eine Verbindung der Formel XXXII mit einer Carbonsäure oder einem Äquivalent davon umgesetzt, um ein 1H-Imidazo[4,5-c][1,5]naphthyridin der Formel XXXIII bereitzustellen. Geeignete Äquivalente zu Carbonsäure beinhalten Säurehalogenide, Orthoester und 1,1-Dialkoxyalkylalkanoate. Die Carbonsäure oder das Äquivalent wird so gewählt, dass der gewünschte R2-Substituent in einer Verbindung der Formel XXXIII bereitgestellt wird. Diethoxymethylacetat liefert beispielsweise eine Verbindung, worin R2 Wasserstoff ist, und Trimethylorthovalerat liefert eine Verbindung, worin R2 Butyl ist. Die Reaktion kann in Abwesenheit von Lösungsmittel in einer Carbonsäure, wie Essigsäure, oder in Anwesenheit einer Säure in einem inerten Lösungsmittel durchgeführt werden. Die Reaktion wird unter ausreichendem Erwärmen durchgeführt, um jeglichen Alkohol oder jegliches Wasser auszutreiben, der bzw. das als Nebenprodukt der Reaktion gebildet wird.
- Alternativ kann Stufe (4) durchgeführt werden, indem (i) eine Verbindung der Formel XXXII mit einem Acylierungsmittel umgesetzt wird und danach (ii) das Produkt cyclisiert wird. Teil (i) beinhaltet die Umsetzung einer Verbindung der Formel XXXII mit einem Acylhalogenid der Formel R2C(O)X, wobei R2 wie bereits definiert ist und X Chlor oder Brom ist. Die Reaktion kann durchgeführt werden, indem das Acylhalogenid bei niedriger Temperatur (z. B. 0°C) in kontrollierter Weise (z. B. tropfenweise) zu einer Lösung einer Verbindung der Formel XXXII in einem geeigneten Lösungsmittel, wie Dichlormethan, gegeben wird. Das resultierende Amidzwischenprodukt kann durch Entfernen des Lösungsmittels isoliert werden. Teil (ii) beinhaltet die Cyclisierung des Produkts in Teil (i), indem es bei einer erhöhten Temperatur (z. B. 150°C) und erhöhtem Druck mit methanolischem Ammoniak umgesetzt wird.
- In Stufe (5) von Reaktionsschema III wird eine Verbindung der Formel XXXIII mit einem konventionellen Oxidationsmittel, das N-Oxide bilden kann, oxidiert, um ein 1H-Imidazo[4,5-c][1,5]naphthyridin-5N-oxid der Formel XXXIV zu bilden. Die bevorzugten Reaktionsbedingungen umfassen die Umsetzung einer Verbindung der Formel XXXIII in Chloroform mit 3-Chlorperoxybenzoesäure bei Umgebungsbedingungen.
- In Stufe (6) von Reaktionsschema III wird eine Verbindung der Formel XXXIV aminiert, um ein 1H-Imidazo[4,5-c][1,5]naphthyridin-4-amin der Formel XXXV zu liefern, das eine Unterart der Formel I ist. Stufe (6) umfasst (i) die Umsetzung einer Verbindung der Formel XXXIV mit einem Acylierungsmittel und nachfolgend (ii) die Umsetzung des Produkts mit einem Aminierungsmittel. Teil (i) von Stufe (6) beinhaltet die Umsetzung eines N-Oxids mit einem Acylierungsmittel. Zu geeigneten Acylierungsmitteln gehören Alkyl- oder Arylsulfonylchloride (z. B. Benzolsulfonylchlorid, Methansulfonylchlorid, p-Toluolsulfonylchlorid). Arylsulfonylchloride sind bevorzugt, p-Toluolsulfonylchlorid ist am meisten bevorzugt. In Teil (ii) von Stufe (6) wird das Produkt von Teil (i) mit einem Überschuss eines Aminierungsmittels umgesetzt. Zu geeigneten Aminierungsmitteln gehören Ammoniak (z. B. in Form von Ammoniumhydroxid) und Ammoniumsalze (z. B. Ammoniumcarbonat, Ammoniumbicarbonat, Ammoniumphosphat). Bevorzugt ist Ammoniumhydroxid. Die Reaktion wird vorzugsweise durchgeführt, indem das N-Oxid der Formel XXXIV in einem inerten Lösungsmittel, wie Dichlormethan, gelöst wird, das Aminierungsmittel zu der Lösung gegeben wird und danach das Acylierungsmittel zugegeben wird. Bevorzugte Bedingungen beinhalten das Abkühlen auf etwa 0°C bis etwa 5°C während der Zugabe des Acylierungsmittels. Das Produkt oder ein pharmazeutisch annehmbares Salz davon kann nach konventionellen Verfahren isoliert werden.
- Alternativ kann Stufe (6) durchgeführt werden, indem (i) eine Verbindung der Formel XXXIV mit einem Isocyanat umgesetzt wird und danach (ii) das Produkt hydrolysiert wird. Teil (i) beinhaltet die Umsetzung des N-Oxids mit einem Isocyanat, wobei die Isocyanatgruppe an eine Carbonylgruppe gebunden ist. Zu bevorzugten Isocyanaten gehören Trichloracetylisocyanat und Aroylisocyanate, wie Benzoylisocyanat. Die Reaktion des Isocyanats mit dem N-Oxid wird unter im Wesentlichen wasserfreien Bedingungen durchgeführt, indem das Isocy anat zu einer Lösung des N-Oxids in einem inerten Lösungsmittel, wie Dichlormethan, gegeben wird. Das resultierende Produkt kann durch Entfernen des Lösungsmittels isoliert werden. In Teil (ii) wird das Produkt aus Teil (i) hydrolysiert. Die Reaktion kann nach konventionellen Verfahren durchgeführt werden, wie Erwärmen in Gegenwart von Wasser oder einem niederen Alkanol, gegebenenfalls in Gegenwart eines Katalysators, wie eines Alkalimetallhydroxids oder niederen Alkoxids.
- Bestimmte funktionale Gruppen, die im Zusammenhang mit R1 und R2 genannt sind, sind möglicherweise mit einigen der Reagenzien des Reaktionsschemas III unverträglich. Verbindungen, die derartige funktionale Gruppen enthalten, können von Fachleuten unter Verwendung wohl bekannter Verfahren des Schutzes und der Manipulation von funktionalen Gruppen hergestellt werden. Amingruppen können bei Bedarf beispielsweise geschützt werden, indem sie mit Di-tert.-butyldicarbonat derivatisiert werden.
- Einige Verbindungen der Formel I, die bestimmte funktionale Gruppen enthalten, können leicht aus anderen Verbindungen der Formel I hergestellt werden. Verbindungen, in denen der R1-Substituent eine Amidgruppe enthält, lassen sich beispielsweise bequem herstellen, indem ein Säurechlorid mit einer Verbindung der Formel I umgesetzt wird, wobei der R1-Substituent ein primäres Amin enthält. Verbindungen, in denen der R1-Substituent eine Harnstoffgruppe enthält, lassen sich in ähnlicher Weise herstellen, indem ein Isocyanat mit einer Verbindung der Formel I umgesetzt wird, wobei der R1-Substituent ein primäres Amin enthält. Verbindungen, in denen der R1-Substituent eine Carbamatgruppe enthält, lassen sich ferner herstellen, indem ein Chlorformiat mit einer Verbindung der Formel I umgesetzt wird, wobei der R1-Substituent ein primäres Amin enthält.
- PHARMAZEUTISCHE ZUSAMMENSETZUNGEN UND BIOLOGISCHE AKTIVITÄT
- Erfindungsgemäße pharmazeutische Zusammensetzungen enthalten eine therapeutisch wirksame Menge der Verbindung 2-Methyl-1-(2-methylpropyl)-1H-imidazo[4,5-c][1,5]naphthyridin-4-amin oder eines pharmazeutisch annehmbaren Salzes davon in Kombination mit einem pharmazeutisch annehmbaren Träger. Der Begriff "therapeutisch wirksame Menge" bedeutet hier eine Menge der Verbindung, die ausreicht, um eine therapeutische Wirkung herbeizuführen, wie eine Cytokin-Induktion oder antivirale Aktivität. Obwohl die genaue Menge der in einer erfindungsgemäßen pharmazeutischen Zusammensetzung verwendeten aktiven Verbindung gemäß Faktoren variieren wird, die Fachleuten bekannt sind, wie der physikalischen und chemischen Natur der Verbindung sowie der Natur des Trägers und dem vorgesehenen Dosierschema, ist vorgesehen, dass die erfindungsgemäßen Zusammensetzungen ausreichend aktiven Bestandteil enthalten, um das Subjekt mit einer Dosis von etwa 100 ng/kg bis etwa 50 mg/kg, vorzugsweise etwa 10 μg/kg bis etwa 5 mg/kg der Verbindung zu versorgen. Es können beliebige der konventionellen Dosierformen verwendet werden, wie Tabletten, Lutschpastillen, parenterale Formulierungen, Sirups, Cremes, Salben, Aerosolformulierungen, Transdermalpflaster, Transmukosalpflaster und dergleichen.
- Es ist in Experimenten, die gemäß dem nachfolgend beschriebenen Testverfahren durchgeführt worden sind, gezeigt worden, dass die erfindungsgemäßen Verbindungen die Produktion bestimmter Cytokine induzieren. Diese Fähigkeit zeigt, dass die Verbindungen als Modifizierungsmittel der Immunreaktion brauchbar sind, die die Immunreaktion auf zahlreiche Weisen modulieren können, wodurch sie zur Behandlung vieler verschiedener Störungen brauchbar werden.
- Cytokine, die durch die Verabreichung erfindungsgemäßer Verbindungen induziert werden, umfassen allgemein Interferon (IFN) und Tumornekrosefaktor (TNF) sowie bestimmte Interleukine (IL). Die Verbindungen induzieren insbesondere IFN-α, TNF-α, IL-1, 6, 10 und 12, sowie eine Vielzahl anderer Cytokine. Cytokine inhibieren unter anderem die Virusproduktion und das Tumorzellwachstum, wodurch die Verbindungen zur Behandlung von Tumoren und Viruserkrankungen brauchbar sind.
- Zusätzlich zu der Fähigkeit, die Produktion von Cytokinen zu induzieren, beeinflussen die Verbindungen andere Aspekte der Immunreaktion. Die Aktivität der natürlichen Killerzellen kann beispielsweise stimuliert werden, eine Wirkung, die auf die Cytokin-Induktion zurückgeführt werden kann. Die Verbindungen können auch Makrophagen aktivieren, wodurch wiederum die Sekretion von Stickoxid und die Produktion weiterer Cytokine stimuliert wird. Die Verbindungen können ferner die Proliferation und Differenzierung von B-Lymphozyten herbeiführen.
- Erfindungsgemäße Verbindungen haben auch eine Wirkung auf die erworbene Immunreaktion. Obwohl beispielsweise keine direkte Wirkung auf T-Zellen oder direkte Induktion von T-Zellen-Cytokinen angenommen wird, wird bei Verabreichung der Verbindungen indirekt die Produktion des T-Helfer-Cytokins Typ I (Th1) IFN-γ induziert und die Produktion des Th2-Cytokins IL-5 inhibiert. Diese Aktivität bedeutet, dass die Verbindungen zur Behandlung von Erkrankungen brauchbar sind, bei denen die Th1-Reaktion nach oben und/oder die Th2-Reaktion nach unten reguliert werden sollen. In Anbetracht der Fähigkeit der obigen Verbindungen, die T-Helfer-Immunreaktion vom Typ 2 zu inhibieren, wird erwartet, dass die Verbindungen zur Behandlung von Atopie, z. B. atopischer Dermatitis, Asthma, Allergie, allergischer Rhinitis; als Impfhilfsstoff für Zell-vermittelte Immunität und möglicherweise als Behandlung für erneut auftretende Pilzerkrankungen und Chlamydien brauchbar sind.
- Die Immunreaktion-modifizierenden Wirkungen der Verbindungen lassen sie zur Behandlung vieler verschiedener Zustände nützlich erscheinen. Weil die Verbindungen Cytokine, wie IFN-α und TNF-α, induzieren können, sind sie zur Behandlung von Viruserkrankungen und Tumoren besonders brauchbar. Diese immunmodulierende Wirkung legt nahe, dass erfindungsgemäße Verbindungen zur Behandlung von Erkrankungen, wie Viruserkrankungen, z. B. Genitalwarzen, gewöhnlichen Warzen, Plantarwarzen, Hepatitis B, Hepatitis C, Herpes Simplex Typ I und Typ II, Molluscum contagiosum, HIV, CMV, VZV, intraepithelialer Neoplasie der Zervix, menschlichem Papillomavirus und damit zusammenhängender Neoplasie; Pilzerkrankungen, z. B. Candida, Aspergillus, Cryptococcen-Meningitis; neoplastischen Erkrankungen, z. B. Basalzellencarcinom, Haarzellencarcinom, Leukämie, Kaposi-Sarkom, Nierenzellencarcinom, Plattenzellcarcinom, myeloider Leukämie, multiplem Myelom, Melanom, Non-Hodgin-Lymphom, T-Zellen-Lymphom der Haut und anderen Krebsen; Parasitenerkrankungen, z. B. Pneumocystis carinii, Cryptosporidiose, Histoplasmose, Toxoplasmose, Trypanosomeninfektion, Leishmaniose; bakteriellen Infektionen, z. B. Tuberkulose, Mycobacterium avium, brauchbar sind, jedoch nicht auf diese begrenzt. Weitere Krankheiten oder Zustände, die mit den erfindungsgemäßen Verbindungen behandelt werden können, umfassen Ekzem, Eosinophilie, essentielle Thrombozythämie, Lepra, multiple Sklerose, Ommen's Syndrom, rheumatoide Arthritis, systemischer Lupus erythematodes, Lupus erythematodes discoides, Morbus Bowen und Bowen-artige Papulose.
- Die vorliegende Beschreibung beschreibt demnach ein Verfahren zum Induzieren der Cytokinbiosynthese bei einem Tier, umfassend die Verabreichung einer wirksamen Menge der obigen Verbindung an das Tier. Eine wirksame Menge der Verbindung, um die Cytokinbiosynthese zu induzieren, ist eine ausreichende Menge, um ein oder mehrere Zelltypen, wie Monozyten, Makrophagen, dendritische Zellen und B-Zellen, dazu zu veranlassen, eine Menge von einem oder mehreren Cytokinen, wie beispielsweise INF-α, TNF-α, IL-1, 6, 10 und 12, zu produzieren, die gegenüber dem Basisspiegel dieser Cytokine erhöht ist. Die genaue Menge variiert gemäß im Stand der Technik bekannten Faktoren, ist erwartungsgemäß jedoch eine Dosis von etwa 100 ng/kg bis etwa 50 mg/kg, vorzugsweise etwa 10 μg/kg bis etwa 5 mg/kg. Die vorliegende Beschreibung beschreibt ferner ein Verfahren zum Behandeln einer Virusinfektion bei einem Tier, umfassend die Verabreichung einer wirksamen Menge der obigen Verbindung an das Tier. Eine wirksame Menge zur Behandlung oder Inhibierung einer Virusinfektion ist eine Menge, die zu einer Reduktion von einer oder mehreren Manifestationen der Virusinfektion führt, wie viralen Läsionen, Viruslast, Rate der Virusproduktion und Mortalität, verglichen mit unbehandelten Kontrolltieren. Die genaue Menge variiert gemäß im Stand der Technik bekannten Faktoren, ist erwartungsgemäß jedoch eine Dosis von etwa 100 ng/kg bis etwa 50 mg/kg, vorzugsweise etwa 10 μg/kg bis etwa 5 mg/kg.
- Die Erfindung wird durch die folgenden Beispiele näher erläutert, die nur zur Veranschaulichung gegeben werden und in keinerlei Weise einschränkend sein sollen.
- Beispiel 1 (Referenzbeispiel)
- Verbindung der Formel XXXI
- N4-(2-Methylpropyl)-3-nitro[1,5]naphthyridin-4-amin
- Phosphoroxychlorid (0,6 ml, 6,44 mmol) wurde mit N,N-Dimethylformamid umgesetzt, danach zu einer Lösung von 3-Nitro[1,5]naphthyridin-4-ol (1,0 g, 5,23 mmol) in N,N-Dimethylformamid (20 ml) gegeben. Die Reaktionsmischung wurde mit einem ummantelten Kolben unter Verwendung von unter Rückfluss befindlichem Aceton als Wärme quelle erwärmt. Nach 3 Stunden wurde die Reaktionsmischung in Eiswasser gegossen, es wurde Isobutylamin (2,0 ml, 20,1 mmol) zugegeben und die Mischung auf einem Dampfbad erwärmt. Die Reaktionsmischung wurde nach mehreren Stunden auf Umgebungstemperatur abgekühlt, filtriert und mit Wasser gewaschen. Die wässrige Phase wurde mit Dichlormethan extrahiert. Der Dichlormethanextrakt wurde mit wässrigem Natriumbicarbonat gewaschen, mit Wasser gewaschen, über Magnesiumsulfat getrocknet, danach auf eine Schicht Silikagel geladen. Das Silikagel wurde zuerst mit Dichlormethan eluiert, um eine Verunreinigung zu entfernen, danach mit 5% Methanol in Dichlormethan, um das Produkt zu gewinnen. Das eluierte Material wurde zur Trockne konzentriert, um N4-(2-Methylpropyl)-3-nitro[1,5]naphthyridin-4-amin als Feststoff zu liefern, Schmelzpunkt 97–99°C.
- Beispiel 2 (Referenzbeispiel)
- Verbindung der Formel XXXIII
- 2-Methyl-1-(2-methylpropyl)-1H-imidazo[4,5-c][1,5]naphthyridin
- Teil A:
- Magnesiumsulfat (3 g) und eine katalytische Menge 5% Platin auf Kohle wurden zu einer Lösung von N4-(2-Methylpropyl)-3-nitro[1,5]naphthyridin-4-amin (4,0 g, 16,2 mmol) in Ethylacetat (250 ml) gegeben. Die Reaktionsmischung wurde vier Stunden in einer Parr-Apparatur mit 50 psi (3,5 kg/cm2) Wasserstoff reduziert. Die Reaktionsmischung wurde filtriert, um den Katalysator zu entfernen, und das Filtrat wurde unter Vakuum konzentriert, um N4-(2-Methylpropyl)[1,5]naphthyridin-3,4-diamin als Rohfeststoff zu liefern.
- Teil B:
- Der Rohfeststoff aus Teil A wurde in Essigsäure aufgenommen, mit Acetanhydrid kombiniert, danach über Nacht auf Rückfluss erwärmt. Die Reaktionsmischung wurde unter Vakuum konzentriert. Der resultierende Rückstand wurde mit Methanol kombiniert, um überschüssiges Acetanhydrid zu zersetzen, und danach unter Vakuum konzentriert. Der resultierende Rückstand wurde mit Cyclohexan kombiniert, danach unter Vakuum konzentriert, um die Essigsäure zu entfernen. Der resultierende Rückstand wurde aus Hexanen umkristallisiert, um 2,2 g 2-Methyl-1-(2-methylpropyl)-1H-imidazo[4,5-c][1,5]naphthyridin als schmutzigweiße Nadeln zu liefern, Schmelzpunkt 118–119°C. Analyse: Berechnet für C14H16N4: %C, 69,97; %H, 6,71; %N, 23,31; gefunden: %C, 69,24; %H, 6,67; %N, 23,23.
- Beispiel 3 (Referenzbeispiel)
- Verbindung der Formel XXXIV
- 2-Methyl-1-(2-methylpropyl)-1H-imidazo[4,5-c][1,5]naphthyridin-5N-oxid
- 3-Chlorperoxybenzoesäure (4,5 g 50% Säure, 13,1 mmol) wurde über einen Zeitraum von 30 Minuten bei Umgebungstemperatur in kleinen Portionen zu einer Lösung von 2-Methyl-1-(2-methylpropyl)-1H-imidazo[4,5-c][1,5]naphthyridin (2,1 g, 8,7 mmol) in Chloroform gegeben. Nach 3 Stunden wurde die Reaktionsmischung mit Chloroform verdünnt, zwei Mal mit 2,0 M Natriumhydroxid, einmal mit Wasser und einmal mit Salzlösung gewaschen, über Magnesiumsulfat getrocknet, danach unter Vakuum konzentriert. Der Rückstand wurde mit Flash-Chromatographie gereinigt (Silikagel, wobei mit 5% Methanol in Dichlormethan eluiert wurde), um 2-Methyl-1-(2-methylpropyl)-1H-imidazo[4,5-c][1,5]naphthyridin-5N-oxid als Feststoff zu liefern, Schmelzpunkt 228–230°C. Analyse: berechnet für C14H16N4O: %C, 65,61; %H, 6,29; %N, 21,86; gefunden: %C, 65,73; %H, 6,31; %N, 21,95.
- Beispiel 4
- Verbindung der Formel I
- Ammoniumhydroxid (10 ml) wurde zu einer Lösung von 2-Methyl-1-(2-methylpropyl)-1H-imidazo[4,5-c][1,5]naphthyridin-5N-oxid (1,1 g, 4,29 mmol) in Dichlormethan (50 ml) gegeben. Die Reaktionsmischung wurde in einem Eisbad gekühlt, danach wurde Tosylchlorid (0,82 g, 4,29 mmol) in Dichlormethan zugegeben. Die Reaktion wurde auf etwa 30°C erwärmt, während sie schnell gerührt wurde. Die Reaktionsmischung wurde bei Umgebungstemperatur über Nacht gerührt. Die Dichlormethanphase wurde abgetrennt, mit 10% Natriumhydroxid, Wasser und Salzlösung gewaschen, über Magnesiumsulfat getrocknet, danach unter Vakuum konzentriert. Der Rückstand wurde aus Ethylacetat umkristallisiert, um 0,8 g 2-Methyl-1-(2-methylpropyl)-1H-imidazo[4,5-c][1,5]naphthyridin-4-amin als Feststoff zu liefern, Schmelzpunkt 228–230°C. Analyse: berechnet für C14H17N5: %C, 65,86; %H, 6,71; %N, 27,43; gefunden: %C, 65,65; %H, 6,69; %N, 27,59.
- TESTVERFAHREN
- CYTOKIN-INDUKTION IN MENSCHLICHEN ZELLEN
- Es wurde ein in-vitro-Zellsystem für menschliches Blut verwendet, um die Cytokin-Induktion durch erfindungsgemäße Verbindungen zu bewerten, Die Aktivität basierte auf der Messung von Interferon und Tumornekrosefaktor (α) (IFN beziehungsweise TNF), die in Kulturmedien sekretiert wurden, wie von Testerman et al. in "Cytokine Induction by the Immunomodulators Imiquimod and S- 27609", Journal of Leukocyte Biology, 58, 365–372 (September 1995) beschrieben worden ist.
- Blutzellenpräparation zur Kultur
- Durch Venenpunktion wurde von gesunden menschlichen Spendern Vollblut in EDTA-Vacutainer-Röhrchen gewonnen. Die peripheren einkernigen Blutzellen (PBMCs) wurden mittels Histopaque®-1077 (Sigma Chemicals, St. Louis, MO, USA) Dichtegradientenzentrifugation von dem Vollblut abgetrennt. Die PBMCs wurden mit 1,5–2 × 106 Zellen/ml in RPMI 1640 Medium suspendiert, das 10% fetales Rinderserum, 2 ml L-Glutamin und 1% Penicillin/Streptomycin-Lösung enthielt (RPMI komplett). 1 ml Portionen PBMC-Suspension wurden in sterile 24 Mulden-Gewebekulturplatten mit flachem Boden gegeben.
- Vorbereitung der Verbindung
- Die Verbindungen wurden in Dimethylsulfoxid (DMSO) solubilisiert. Die DMSO-Konzentration sollte zur Zugabe zu den Kulturmulden eine Endkonzentration von 1% nicht überschreiten. Die Verbindungen wurden allgemein in einem Konzentrationsbereich von 0,1 bis 100 μM getestet.
- Inkubation
- Die Lösung der Testverbindung wurde zu den Mulden gegeben, die 1 ml PBMCs in Medien enthielten. Die Platten wurden mit Kunststoffdeckeln abgedeckt, vorsichtig gemischt und danach 18 bis 24 Stunden bei 37°C in einer Atmosphäre mit 5% Kohlendioxid inkubiert.
- Trennung
- Nach dem Inkubieren wurden die Platten 5 bis 10 Minuten bei 4°C mit 1000 UpM (etwa 200 × g) zentrifugiert. Der Überstand der Zellkultur wurde mit einer sterilen Polypropylenpipette entfernt und in ein steriles 2 ml Kryoröhrchen überführt. Bis zur Analyse wurden die Proben auf –70°C gehalten.
- Interferonanalyse/-berechnung
- Interferon wurde mittels Bioassay unter Verwendung von menschlichen Lungencarcinomzellen A549 bestimmt, die mit Encephalomyocarditis provoziert worden waren. Die Details des Bioassay-Verfahrens sind von G. L. Brennan und L. M. Kronenberg in "Automated Bioassay of Interferons in Micro-test Plates", Biotechniques, Juni/Juli, 78, 1983, beschrieben worden, zitiert zum Zweck der Bezugnahme. Kurz gesagt arbeitet das Verfahren wie folgt: A549-Zellen werden mit Proben und Standard-Interferon-Verdünnungen bei 37°C 24 Stunden inkubiert. Die inkubierten Zellen werden danach mit einem Inokulum des Encephalomyokarditis-Virus infiziert. Die infizierten Zellen werden weitere 24 Stunden bei 37°C inkubiert, bevor die virale zytopathische Wirkung quantifiziert wird. Die virale zytopathische Wirkung wird durch Anfärben und anschließendes visuelles Bewerten der Platten quantifiziert. Die Ergebnisse werden als α-Referenzeinheiten/ml angegeben, bezogen auf den Wert, der für NIH menschlichen Leukozyten-IFN-Standard erhalten wurde.
- Analyse des Tumornekrosefaktors (α)
- Die Konzentration des Tumornekrosefaktors (α) (TNF) wurde mit einem ELISA-Kit bestimmt, das von Genzyme, Cambridge, MA, USA, erhältlich ist. Die Ergebnisse sind in pg/ml angegeben.
- In der folgenden Tabelle zeigt ein "+", dass die Verbindung in dieser speziellen Konzentration das angegebene Cytokin induzierte, ein "–" zeigt, dass die Verbindung in dieser speziellen Konzentration das angegebene Cytokin nicht induzierte, und ein "±" zeigt, dass die Ergebnisse bei dieser speziellen Konzentration nicht eindeutig waren.
- INTERFERON (α)-INDUKTION IN MENSCHLICHEN ZELLEN
- Es wurde ein in-vitro-Zellsystem für menschliches Blut verwendet, um die Interferon-Induktion durch erfindungsgemäße Verbindungen zu bewerten. Die Aktivität basierte auf der Messung des in Kulturmedien sekretierten Interferons. Interferon wird mittels Bioassay gemessen.
- Blutzellenpräparation zur Kultur
- Durch Venenpunktion in EDTA-Vacutainer-Röhrchen wurde Vollblut gewonnen. Periphere einkernige Blutzellen (PBMs) wurden entweder mit Zelltrennröhrchen der Marke LeucoPREPTM (erhältlich von Becton Dickinson) oder Ficoll-Paque® Lösung (erhältlich von Pharmacia LKB Biotechnology Inc, Piscataway, NJ, USA) von dem Vollblut abgetrennt. Die PBMs wurden in 1 × 106/ml in RPMI 1640 Medien (erhältlich von GIBCO, Grand Island, NY, USA) suspendiert, die 25 mM HEPES (N-2-Hydroxyethylpiperazin-N'-2-ethansulfonsäure) und L-Glutamin enthielten (1% Penicillin-Streptomycin-Lösung wurde zugesetzt), wobei 10% wärmeaktiviertes (30 Minuten bei 56°C) autologes Serum zugegeben wurde. 200 μl Portionen PBM-Suspension wurden in sterile 96 Mulden-Gewebekulturplatten (mit flachem Boden) MicroTest III gegeben.
- Vorbereitung der Verbindung
- Die Verbindungen wurden in Ethanol, Dimethylsulfoxid oder Gewebekulturwasser solubilisiert, danach mit Gewebekulturwasser, 0,01 N Natriumhydroxid oder 0,01 N Salzsäure verdünnt (die Wahl des Lösungsmittels hängt von den chemischen Charakteristika der im Test befindlichen Verbindung ab). Die Ethanol- oder DMSO-Konzentration sollte zur Zugabe zu den Kulturmulden eine Endkonzentration von 1% nicht überschreiten. Die Verbindungen wurden zuerst in einem Konzentrationsbereich von etwa 0,1 μg/ml bis etwa 5 μg/l getestet. Verbindungen, die in einer Konzentration von 0,5 μg/ml Induktion zeigten, wurden dann in einem erweiterten Konzentrationsbereich getestet.
- Inkubation
- Die Lösung der Testverbindung wurde in einem Volumen (kleiner als oder gleich 50 μl) zu den Mulden gegeben, die 200 μl verdünntes Vollblut oder PBMs in Medien enthielten. In Kontrollmulden (Mulden ohne Testverbindung) wurde(n) Lösungsmittel und/oder Medien nach Bedarf gegeben, um das Endvolumen jeder Mulde auf 250 μl einzustellen. Die Platten wurden mit Kunststoffdeckeln abgedeckt, vorsichtig vortexiert und danach 48 Stunden bei 37°C in einer Atmosphäre mit 5% Kohlendioxid inkubiert.
- Trennung
- Nach dem Inkubieren wurden die Platten mit Parafilm bedeckt und danach 10 bis 15 Minuten bei 4°C in einer Damon IEC Modell CRU-5000 Zentrifuge mit 1000 UpM zentrifugiert. Aus 4 bis 8 Mulden wurden Medien (etwa 200 μl) entfernt und in sterile 2 ml Gefrierampullen gepoolt. Bis zur Analyse wurden die Proben auf –70°C gehalten.
- Interferonanalyse/-berechnung
- Interferon wurde mittels Bioassay unter Verwendung von menschlichen Lungencarcinomzellen A549 bestimmt, die mit Encephalomyocarditis provoziert worden waren. Die Details des Bioassay-Verfahrens sind von G. L. Brennan und L. M. Kronenberg in "Automated Bioassay of Interferons in Micro-test Plates", Biotechniques, Juni/Juli, 78, 1983, beschrieben worden, hier zitiert zum Zweck der Bezugnahme. Kurz gesagt arbeitet das Verfahren wie folgt: Interferonverdünnungen und A549-Zellen werden 12 bis 24 Stunden bei 37°C inkubiert. Die inkubierten Zellen werden danach mit einem Inokulum des Encephalomyokarditis-Virus infiziert. Die infizierten Zellen werden einen weiteren Zeitraum bei 37°C inkubiert, bevor die virale zytopathische Wirkung quantifiziert wird. Die virale zytopathische Wirkung wird durch Anfärben und anschließende spektrophotometrische Extinktionsmessungen quantifiziert. Die Ergebnisse werden als α-Referenzeinheiten/ml angegeben, bezogen auf den Wert, der für NIH-HU-IF-L-Standard erhalten wurde. Das Interferon wurde als im Wesentlichen nur Interferon-α identifiziert, indem es unter Verwendung von A549 Zellmonoschichten, die mit Encephalomyokarditis-Virus provoziert worden waren, in Schachbrett-Neutralisationsassays gegen Anti-Human-Interferon (β) des Kaninchens und Anti-Human-Interferon (α) der Ziege getestet wurde.
- In der folgenden Tabelle zeigt ein "+", dass die Verbindung in dieser speziellen Konzentration Interferon α induzierte, ein "–" zeigt, dass die Verbindung in dieser speziellen Konzentration Interferon α nicht induzierte, und ein "±" zeigt, dass die Ergebnisse bei dieser speziellen Konzentration nicht eindeutig waren.
- Die vorliegende Erfindung ist in Bezug auf mehrere ihrer Ausführungsformen beschrieben worden. Die vorhergehende detaillierte Beschreibung und Beispiele sind nur zum genauen Verständnis gegeben worden, und daraus sollen sich keine zu weit gehenden Einschränkungen ergeben. Fachleuten ist offensichtlich, dass an den beschriebenen Ausführungsformen viele Veränderungen vorgenommen werden können, ohne den Schutzumfang der Erfindung zu verlassen. Der Schutzumfang der Erfindung soll somit nicht auf die genauen Details der hier beschriebenen Zusammensetzungen und Strukturen begrenzt sein, sondern durch den Wortlaut der folgenden Ansprüche.
R2 ausgewählt ist aus der Gruppe bestehend aus:
– Wasserstoff;
– C1-10-Alkyl;
– C2-10-Alkenyl;
– Aryl;
– C1-10-Alkyl-O-C1-10-alkyl;
– C1-10-Alkyl-O-C2-10-Alkenyl und
– C1-10-Alkyl oder C2-10-Alkenyl, das mit einem oder mehreren Substituenten substituiert ist, die ausgewählt sind aus der Gruppe bestehend aus:
– OH;
– Halogen;
– N(R3)2;
– CO-N(R3)2;
– CO-C1-10-Alkyl;
– N3;
– Aryl;
– Heteroaryl;
– Heterocyclyl;
– CO-Aryl und
– CO-Heteroaryl;
jedes R3 unabhängig ausgewählt ist aus der Gruppe bestehend aus Wasserstoff und C1-10-Alkyl, und
jedes R unabhängig ausgewählt ist aus der Gruppe bestehend aus Wasserstoff, C1-10-Alkyl, C1-10-Alkoxy, Halogen und Trifluormethyl, oder ein pharmazeutisch annehmbares Salz davon.
Claims (6)
- Verbindung 2-Methyl-1-(2-methylpropyl)-1H-imidazo[4,5-c][1,5]naphthyridin-4-amin oder ein pharmazeutisch verträgliches Salz davon.
- Arzneimittel, die eine pharmazeutisch wirksame Menge der Verbindung oder des Salzes nach Anspruch 1 und einen pharmazeutisch verträglichen Träger umfasst.
- Verbindung oder Salz nach Anspruch 1 zur Verwendung in einem Verfahren zum Induzieren von Cytokinbiosynthese bei einem Tier.
- Verwendung der Verbindung oder des Salzes nach Anspruch 1 zur Herstellung eines Medikaments zum Induzieren von Cytokinbiosynthese bei einem Tier.
- Verbindung oder Salz nach Anspruch 1 zur Verwendung in einem Verfahren zur Behandlung einer Virusinfektion bei einem Tier.
- Verwendung der Verbindung oder des Salzes nach Anspruch 1 zur Herstellung eines Medikaments zur Behandlung einer Virusinfektion bei einem Tier.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US6927697P | 1997-12-11 | 1997-12-11 | |
| US69276P | 1997-12-11 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69835309D1 DE69835309D1 (de) | 2006-08-31 |
| DE69835309T2 true DE69835309T2 (de) | 2007-07-19 |
Family
ID=22087889
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69826518T Expired - Fee Related DE69826518T2 (de) | 1997-12-11 | 1998-12-11 | Imidazonaphthyridinderivate und ihre verwendung zur induzierung von biosythese von cytokin |
| DE69835309T Expired - Lifetime DE69835309T2 (de) | 1997-12-11 | 1998-12-11 | Imidazonaphthyridinderivate und ihre verwendung zur induzierung von biosythese von cytokin |
| DE69835844T Expired - Fee Related DE69835844T2 (de) | 1997-12-11 | 1998-12-11 | Imidazonaphthyridine und ihre verwendung zur induzierung der biosynthese von cytokin |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69826518T Expired - Fee Related DE69826518T2 (de) | 1997-12-11 | 1998-12-11 | Imidazonaphthyridinderivate und ihre verwendung zur induzierung von biosythese von cytokin |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69835844T Expired - Fee Related DE69835844T2 (de) | 1997-12-11 | 1998-12-11 | Imidazonaphthyridine und ihre verwendung zur induzierung der biosynthese von cytokin |
Country Status (28)
| Country | Link |
|---|---|
| US (14) | US6194425B1 (de) |
| EP (1) | EP1040112B1 (de) |
| JP (4) | JP4283438B2 (de) |
| KR (3) | KR100642703B1 (de) |
| CN (1) | CN1154647C (de) |
| AT (3) | ATE277046T1 (de) |
| AU (1) | AU753864B2 (de) |
| BR (1) | BR9814275A (de) |
| CA (1) | CA2311456C (de) |
| CZ (1) | CZ307184B6 (de) |
| DE (3) | DE69826518T2 (de) |
| DK (1) | DK1512686T3 (de) |
| EE (1) | EE04314B1 (de) |
| ES (3) | ES2273138T3 (de) |
| HK (1) | HK1070655A1 (de) |
| HR (1) | HRP20000363B1 (de) |
| HU (1) | HUP0101155A3 (de) |
| IL (4) | IL136556A0 (de) |
| NO (3) | NO316687B1 (de) |
| NZ (1) | NZ504776A (de) |
| PL (1) | PL193915B1 (de) |
| PT (3) | PT1512685E (de) |
| RU (3) | RU2221798C2 (de) |
| SI (1) | SI1512686T1 (de) |
| SK (2) | SK285872B6 (de) |
| TR (1) | TR200001705T2 (de) |
| UA (1) | UA67760C2 (de) |
| WO (1) | WO1999029693A1 (de) |
Families Citing this family (223)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5741908A (en) | 1996-06-21 | 1998-04-21 | Minnesota Mining And Manufacturing Company | Process for reparing imidazoquinolinamines |
| UA67760C2 (uk) * | 1997-12-11 | 2004-07-15 | Міннесота Майнінг Енд Мануфакчурінг Компані | Імідазонафтиридин та тетрагідроімідазонафтиридин, фармацевтична композиція, спосіб індукування біосинтезу цитокінів та спосіб лікування вірусної інфекції, проміжні сполуки |
| US6518280B2 (en) | 1998-12-11 | 2003-02-11 | 3M Innovative Properties Company | Imidazonaphthyridines |
| US20020058674A1 (en) | 1999-01-08 | 2002-05-16 | Hedenstrom John C. | Systems and methods for treating a mucosal surface |
| CN1555264A (zh) | 1999-01-08 | 2004-12-15 | 3M | 用于治疗粘膜病症的含咪喹莫特或其它免疫应答调节剂的制剂 |
| US6486168B1 (en) | 1999-01-08 | 2002-11-26 | 3M Innovative Properties Company | Formulations and methods for treatment of mucosal associated conditions with an immune response modifier |
| US6558951B1 (en) * | 1999-02-11 | 2003-05-06 | 3M Innovative Properties Company | Maturation of dendritic cells with immune response modifying compounds |
| EP1642580B8 (de) * | 1999-06-10 | 2009-11-18 | Coley Pharmaceutical Group, Inc. | Imidazoquinoline Sulfonamide |
| EP1438958A1 (de) * | 1999-06-10 | 2004-07-21 | 3M Innovative Properties Company | Carbamat subsituierte Imidazochinoline |
| US6541485B1 (en) | 1999-06-10 | 2003-04-01 | 3M Innovative Properties Company | Urea substituted imidazoquinolines |
| US6756382B2 (en) | 1999-06-10 | 2004-06-29 | 3M Innovative Properties Company | Amide substituted imidazoquinolines |
| US6331539B1 (en) * | 1999-06-10 | 2001-12-18 | 3M Innovative Properties Company | Sulfonamide and sulfamide substituted imidazoquinolines |
| US6573273B1 (en) * | 1999-06-10 | 2003-06-03 | 3M Innovative Properties Company | Urea substituted imidazoquinolines |
| US6451810B1 (en) * | 1999-06-10 | 2002-09-17 | 3M Innovative Properties Company | Amide substituted imidazoquinolines |
| US6916925B1 (en) | 1999-11-05 | 2005-07-12 | 3M Innovative Properties Co. | Dye labeled imidazoquinoline compounds |
| US6376669B1 (en) * | 1999-11-05 | 2002-04-23 | 3M Innovative Properties Company | Dye labeled imidazoquinoline compounds |
| JP3436512B2 (ja) * | 1999-12-28 | 2003-08-11 | 株式会社デンソー | アクセル装置 |
| US6894060B2 (en) | 2000-03-30 | 2005-05-17 | 3M Innovative Properties Company | Method for the treatment of dermal lesions caused by envenomation |
| US20040209877A1 (en) * | 2000-04-13 | 2004-10-21 | Shelby Nancy J. | Methods for augmenting immune defenses contemplating the administration of phenolic and indoleamine-like compounds for use in animals ans humans |
| UA75622C2 (en) * | 2000-12-08 | 2006-05-15 | 3M Innovative Properties Co | Aryl ether substituted imidazoquinolines, pharmaceutical composition based thereon |
| US6664264B2 (en) * | 2000-12-08 | 2003-12-16 | 3M Innovative Properties Company | Thioether substituted imidazoquinolines |
| JP2008531580A (ja) * | 2000-12-08 | 2008-08-14 | スリーエム イノベイティブ プロパティズ カンパニー | 免疫応答修飾因子の標的化送達のための組成物および方法 |
| US6660747B2 (en) * | 2000-12-08 | 2003-12-09 | 3M Innovative Properties Company | Amido ether substituted imidazoquinolines |
| US6667312B2 (en) * | 2000-12-08 | 2003-12-23 | 3M Innovative Properties Company | Thioether substituted imidazoquinolines |
| US6660735B2 (en) * | 2000-12-08 | 2003-12-09 | 3M Innovative Properties Company | Urea substituted imidazoquinoline ethers |
| US6677347B2 (en) * | 2000-12-08 | 2004-01-13 | 3M Innovative Properties Company | Sulfonamido ether substituted imidazoquinolines |
| US6664265B2 (en) | 2000-12-08 | 2003-12-16 | 3M Innovative Properties Company | Amido ether substituted imidazoquinolines |
| US6525064B1 (en) | 2000-12-08 | 2003-02-25 | 3M Innovative Properties Company | Sulfonamido substituted imidazopyridines |
| EP1360486A2 (de) * | 2000-12-08 | 2003-11-12 | 3M Innovative Properties Company | Screeningverfahren zur identifizierung von selektiven interferon-alpha-induzierenden verbindungen |
| US6677348B2 (en) * | 2000-12-08 | 2004-01-13 | 3M Innovative Properties Company | Aryl ether substituted imidazoquinolines |
| US6545016B1 (en) | 2000-12-08 | 2003-04-08 | 3M Innovative Properties Company | Amide substituted imidazopyridines |
| UA74593C2 (en) * | 2000-12-08 | 2006-01-16 | 3M Innovative Properties Co | Substituted imidazopyridines |
| US6545017B1 (en) | 2000-12-08 | 2003-04-08 | 3M Innovative Properties Company | Urea substituted imidazopyridines |
| US6664260B2 (en) * | 2000-12-08 | 2003-12-16 | 3M Innovative Properties Company | Heterocyclic ether substituted imidazoquinolines |
| US7226928B2 (en) * | 2001-06-15 | 2007-06-05 | 3M Innovative Properties Company | Methods for the treatment of periodontal disease |
| US20030133913A1 (en) * | 2001-08-30 | 2003-07-17 | 3M Innovative Properties Company | Methods of maturing plasmacytoid dendritic cells using immune response modifier molecules |
| DK1719511T3 (da) * | 2001-11-16 | 2009-04-14 | Coley Pharm Group Inc | N-[4-(4-amino-2-ethyl-1H-imidazo[4,5-c]quinolin-1-yl)butyl]methansulfonamid, en farmaceutisk sammensætning omfattende samme, og anvendelse deraf |
| ES2312659T3 (es) | 2001-11-29 | 2009-03-01 | 3M Innovative Properties Company | Formulaciones farmaceuticas que comprenden un modificador de la respuesta inmune. |
| CA2365732A1 (en) * | 2001-12-20 | 2003-06-20 | Ibm Canada Limited-Ibm Canada Limitee | Testing measurements |
| US6677349B1 (en) | 2001-12-21 | 2004-01-13 | 3M Innovative Properties Company | Sulfonamide and sulfamide substituted imidazoquinolines |
| JP2005518433A (ja) * | 2002-02-22 | 2005-06-23 | スリーエム イノベイティブ プロパティズ カンパニー | Uvb−誘導免疫抑制を軽減し治療する方法 |
| JP2005538057A (ja) | 2002-06-07 | 2005-12-15 | スリーエム イノベイティブ プロパティズ カンパニー | エーテル置換イミダゾピリジン |
| AU2003299863B2 (en) | 2002-08-15 | 2009-09-24 | 3M Innovative Properties Company | Immunostimulatory compositions and methods of stimulating an immune response |
| AU2003299082A1 (en) * | 2002-09-26 | 2004-04-19 | 3M Innovative Properties Company | 1h-imidazo dimers |
| AU2003287324A1 (en) * | 2002-12-11 | 2004-06-30 | 3M Innovative Properties Company | Gene expression systems and recombinant cell lines |
| AU2003287316A1 (en) * | 2002-12-11 | 2004-06-30 | 3M Innovative Properties Company | Assays relating to toll-like receptor activity |
| AU2003301052A1 (en) | 2002-12-20 | 2004-07-22 | 3M Innovative Properties Company | Aryl / hetaryl substituted imidazoquinolines |
| US7387271B2 (en) | 2002-12-30 | 2008-06-17 | 3M Innovative Properties Company | Immunostimulatory combinations |
| WO2004071459A2 (en) * | 2003-02-13 | 2004-08-26 | 3M Innovative Properties Company | Methods and compositions related to irm compounds and toll-like receptor 8 |
| US7485432B2 (en) * | 2003-02-27 | 2009-02-03 | 3M Innovative Properties Company | Selective modulation of TLR-mediated biological activity |
| AU2004218349A1 (en) | 2003-03-04 | 2004-09-16 | 3M Innovative Properties Company | Prophylactic treatment of UV-induced epidermal neoplasia |
| US7163947B2 (en) * | 2003-03-07 | 2007-01-16 | 3M Innovative Properties Company | 1-Amino 1H-imidazoquinolines |
| CA2517655A1 (en) * | 2003-03-07 | 2004-09-23 | 3M Innovative Properties Company | 1-amino 1h-imidazoquinolines |
| MXPA05009694A (es) * | 2003-03-13 | 2005-10-20 | 3M Innovative Properties Co | Metodos para mejorar la calidad de la piel. |
| WO2004080293A2 (en) * | 2003-03-13 | 2004-09-23 | 3M Innovative Properties Company | Methods for diagnosing skin lesions |
| CA2518445A1 (en) | 2003-03-13 | 2004-09-23 | 3M Innovative Properties Company | Method of tattoo removal |
| US20040192585A1 (en) * | 2003-03-25 | 2004-09-30 | 3M Innovative Properties Company | Treatment for basal cell carcinoma |
| ES2423800T3 (es) | 2003-03-28 | 2013-09-24 | Novartis Vaccines And Diagnostics, Inc. | Uso de compuestos orgánicos para la inmunopotenciación |
| AU2004244962A1 (en) * | 2003-04-10 | 2004-12-16 | 3M Innovative Properties Company | Delivery of immune response modifier compounds using metal-containing particulate support materials |
| US20040265351A1 (en) * | 2003-04-10 | 2004-12-30 | Miller Richard L. | Methods and compositions for enhancing immune response |
| EP1617845A4 (de) * | 2003-04-28 | 2006-09-20 | 3M Innovative Properties Co | Zusammensetzungen und verfahren zur induktion von opioid-rezeptoren |
| US7731967B2 (en) | 2003-04-30 | 2010-06-08 | Novartis Vaccines And Diagnostics, Inc. | Compositions for inducing immune responses |
| US7176214B2 (en) | 2003-05-21 | 2007-02-13 | Bristol-Myers Squibb Company | Imidazo-fused oxazolo[4,5-β]pyridine and imidazo-fused thiazolo[4,5-β]pyridine based tricyclic compounds and pharmaceutical compositions comprising same |
| WO2004110991A2 (en) * | 2003-06-06 | 2004-12-23 | 3M Innovative Properties Company | PROCESS FOR IMIDAZO[4,5-c]PYRIDIN-4-AMINES |
| WO2004110992A2 (en) * | 2003-06-06 | 2004-12-23 | 3M Innovative Properties Company | Process for imidazo[4,5-c] pyridin-4-amines |
| RU2006102188A (ru) * | 2003-07-31 | 2006-07-10 | ЗМ Инновейтив Пропертиз Компани (US) | Биоактивные композиции, включающие триазины |
| WO2005016273A2 (en) * | 2003-08-05 | 2005-02-24 | 3M Innovative Properties Company | Infection prophylaxis using immune response modifier compounds |
| JP2007502288A (ja) * | 2003-08-12 | 2007-02-08 | スリーエム イノベイティブ プロパティズ カンパニー | オキシム置換イミダゾ含有化合物 |
| JP4913593B2 (ja) * | 2003-08-14 | 2012-04-11 | スリーエム イノベイティブ プロパティズ カンパニー | 脂質修飾された免疫応答調整剤 |
| PL1653959T3 (pl) | 2003-08-14 | 2015-10-30 | 3M Innovative Properties Co | Modyfikatory odpowiedzi immunologicznej modyfikowane lipidami |
| AU2004268616B2 (en) * | 2003-08-25 | 2010-10-07 | 3M Innovative Properties Company | Delivery of immune response modifier compounds |
| EP1660122A4 (de) * | 2003-08-25 | 2007-10-24 | 3M Innovative Properties Co | Immunstimulatorische kombinationen und behandlungen |
| EP1658076B1 (de) * | 2003-08-27 | 2013-03-06 | 3M Innovative Properties Company | Aryloxy- und arylalkylenoxy-substituierte imidazochinoline |
| JP2007504172A (ja) * | 2003-09-02 | 2007-03-01 | スリーエム イノベイティブ プロパティズ カンパニー | 粘膜に関連した症状の処置に関する方法 |
| AU2004270201A1 (en) * | 2003-09-05 | 2005-03-17 | 3M Innovative Properties Company | Treatment for CD5+ B cell lymphoma |
| EP1668010A2 (de) * | 2003-10-01 | 2006-06-14 | Taro Pharmaceuticals U.S.A., Inc. | Verfahren zur herstellung von 4-amino-1h-imidazo[4,5-c]chinolinen und säureadditionssalzen davon |
| BRPI0414856A (pt) | 2003-10-03 | 2006-11-21 | 3M Innovative Properties Co | imidazoquinolinas alcóxi-substituìdas |
| AU2004315876B2 (en) | 2003-10-03 | 2011-05-26 | 3M Innovative Properties Company | Pyrazolopyridines and analogs thereof |
| US7544697B2 (en) | 2003-10-03 | 2009-06-09 | Coley Pharmaceutical Group, Inc. | Pyrazolopyridines and analogs thereof |
| US20090075980A1 (en) * | 2003-10-03 | 2009-03-19 | Coley Pharmaceutical Group, Inc. | Pyrazolopyridines and Analogs Thereof |
| WO2005041891A2 (en) * | 2003-10-31 | 2005-05-12 | 3M Innovative Properties Company | Neutrophil activation by immune response modifier compounds |
| WO2005048945A2 (en) | 2003-11-14 | 2005-06-02 | 3M Innovative Properties Company | Hydroxylamine substituted imidazo ring compounds |
| CA2545774A1 (en) | 2003-11-14 | 2005-06-02 | 3M Innovative Properties Company | Oxime substituted imidazo ring compounds |
| US8778963B2 (en) * | 2003-11-25 | 2014-07-15 | 3M Innovative Properties Company | Hydroxylamine and oxime substituted imidazoquinolines, imidazopyridines, and imidazonaphthyridines |
| US8691837B2 (en) | 2003-11-25 | 2014-04-08 | 3M Innovative Properties Company | Substituted imidazo ring systems and methods |
| US20050226878A1 (en) * | 2003-12-02 | 2005-10-13 | 3M Innovative Properties Company | Therapeutic combinations and methods including IRM compounds |
| US8940755B2 (en) * | 2003-12-02 | 2015-01-27 | 3M Innovative Properties Company | Therapeutic combinations and methods including IRM compounds |
| AU2004315771A1 (en) * | 2003-12-04 | 2005-08-25 | 3M Innovative Properties Company | Sulfone substituted imidazo ring ethers |
| WO2005066172A1 (en) * | 2003-12-29 | 2005-07-21 | 3M Innovative Properties Company | Piperazine, [1,4]diazepane, [1,4]diazocane, and [1,5]diazocane fused imidazo ring compounds |
| WO2005066170A1 (en) | 2003-12-29 | 2005-07-21 | 3M Innovative Properties Company | Arylalkenyl and arylalkynyl substituted imidazoquinolines |
| EP1699398A4 (de) * | 2003-12-30 | 2007-10-17 | 3M Innovative Properties Co | Verbesserung der immunantworten |
| US8735421B2 (en) | 2003-12-30 | 2014-05-27 | 3M Innovative Properties Company | Imidazoquinolinyl sulfonamides |
| CA2559607C (en) * | 2004-03-15 | 2013-02-19 | 3M Innovative Properties Company | Immune response modifier formulations and methods |
| WO2005094531A2 (en) * | 2004-03-24 | 2005-10-13 | 3M Innovative Properties Company | Amide substituted imidazopyridines, imidazoquinolines, and imidazonaphthyridines |
| AU2005244260B2 (en) * | 2004-04-09 | 2010-08-05 | 3M Innovative Properties Company | Methods, compositions, and preparations for delivery of immune response modifiers |
| JP2008505857A (ja) * | 2004-04-28 | 2008-02-28 | スリーエム イノベイティブ プロパティズ カンパニー | 粘膜ワクチン接種のための組成物および方法 |
| US20050267145A1 (en) * | 2004-05-28 | 2005-12-01 | Merrill Bryon A | Treatment for lung cancer |
| US20080015184A1 (en) * | 2004-06-14 | 2008-01-17 | 3M Innovative Properties Company | Urea Substituted Imidazopyridines, Imidazoquinolines, and Imidazonaphthyridines |
| WO2005123080A2 (en) * | 2004-06-15 | 2005-12-29 | 3M Innovative Properties Company | Nitrogen-containing heterocyclyl substituted imidazoquinolines and imidazonaphthyridines |
| WO2006038923A2 (en) * | 2004-06-18 | 2006-04-13 | 3M Innovative Properties Company | Aryl substituted imidazonaphthyridines |
| US8541438B2 (en) | 2004-06-18 | 2013-09-24 | 3M Innovative Properties Company | Substituted imidazoquinolines, imidazopyridines, and imidazonaphthyridines |
| EP1765348B1 (de) * | 2004-06-18 | 2016-08-03 | 3M Innovative Properties Company | Substituierte imidazochinoline, imidazopyridine sowie imidazonaphthyridine |
| US20070259881A1 (en) * | 2004-06-18 | 2007-11-08 | Dellaria Joseph F Jr | Substituted Imidazo Ring Systems and Methods |
| WO2006009826A1 (en) * | 2004-06-18 | 2006-01-26 | 3M Innovative Properties Company | Aryloxy and arylalkyleneoxy substituted thiazoloquinolines and thiazolonaphthyridines |
| WO2006065280A2 (en) * | 2004-06-18 | 2006-06-22 | 3M Innovative Properties Company | Isoxazole, dihydroisoxazole, and oxadiazole substituted imidazo ring compounds and methods |
| CA2571710A1 (en) | 2004-06-24 | 2006-11-02 | Nicholas Valiante | Small molecule immunopotentiators and assays for their detection |
| EP1765313A2 (de) | 2004-06-24 | 2007-03-28 | Novartis Vaccines and Diagnostics, Inc. | Verbindungen als immunstimulatoren |
| EP1786450A4 (de) * | 2004-08-27 | 2009-11-11 | 3M Innovative Properties Co | Hiv-immunstimulatorische zusammensetzungen |
| CA2578741C (en) * | 2004-09-02 | 2014-01-14 | 3M Innovative Properties Company | 1-alkoxy 1h-imidazo ring systems and methods |
| CA2578975A1 (en) | 2004-09-02 | 2006-03-16 | 3M Innovative Properties Company | 2-amino 1h imidazo ring systems and methods |
| US20090270443A1 (en) * | 2004-09-02 | 2009-10-29 | Doris Stoermer | 1-amino imidazo-containing compounds and methods |
| WO2006029223A2 (en) * | 2004-09-08 | 2006-03-16 | Children's Medical Center Corporation | Method for stimulating the immune response of newborns |
| WO2006042254A2 (en) * | 2004-10-08 | 2006-04-20 | 3M Innovative Properties Company | Adjuvant for dna vaccines |
| ES2377758T3 (es) | 2004-11-12 | 2012-03-30 | Bristol-Myers Squibb Company | Compuestos tricíclicos basados en tiazolo[4,5-b]piridina imidazo-fusionada y composiciones farmacéuticas que los comprenden |
| WO2006053166A1 (en) * | 2004-11-12 | 2006-05-18 | Bristol-Myers Squibb Company | 8h-imidazo[4,5-d]thiazolo[4,5-b]pyridine based tricyclic compounds and pharmaceutical compositions comprising same |
| WO2006063072A2 (en) * | 2004-12-08 | 2006-06-15 | 3M Innovative Properties Company | Immunomodulatory compositions, combinations and methods |
| US8080560B2 (en) | 2004-12-17 | 2011-12-20 | 3M Innovative Properties Company | Immune response modifier formulations containing oleic acid and methods |
| CA2594674C (en) | 2004-12-30 | 2016-05-17 | 3M Innovative Properties Company | Substituted chiral fused [1,2]imidazo[4,5-c] ring compounds |
| US8436176B2 (en) * | 2004-12-30 | 2013-05-07 | Medicis Pharmaceutical Corporation | Process for preparing 2-methyl-1-(2-methylpropyl)-1H-imidazo[4,5-c][1,5]naphthyridin-4-amine |
| ES2538498T3 (es) | 2004-12-30 | 2015-06-22 | Meda Ab | Utilización de Imiquimod para el tratamiento de metástasis cutáneas provenientes de un tumor de cáncer de mama |
| WO2006074003A2 (en) | 2004-12-30 | 2006-07-13 | 3M Innovative Properties Company | CHIRAL FUSED [1,2]IMIDAZO[4,5-c] RING COMPOUNDS |
| CA2592897A1 (en) * | 2004-12-30 | 2006-07-13 | Takeda Pharmaceutical Company Limited | 1-(2-methylpropyl)-1h-imidazo[4,5-c][1,5]naphthyridin-4-amine ethanesulfonate and 1-(2-methylpropyl)-1h-imidazo[4,5-c][1,5]naphthyridin-4-amine methanesulfonate |
| CA2595994A1 (en) | 2005-01-27 | 2006-08-03 | Alma Mater Studiorum - Universita' Di Bologna | Organic compounds useful for the treatment of alzheimer's disease, their use and method of preparation |
| US9248127B2 (en) * | 2005-02-04 | 2016-02-02 | 3M Innovative Properties Company | Aqueous gel formulations containing immune response modifiers |
| CA2602083A1 (en) | 2005-02-09 | 2006-08-09 | Coley Pharmaceutical Group, Inc. | Oxime and hydroxylamine substituted thiazolo(4,5-c) ring compounds and methods |
| AU2006212765B2 (en) | 2005-02-09 | 2012-02-02 | 3M Innovative Properties Company | Alkyloxy substituted thiazoloquinolines and thiazolonaphthyridines |
| US8658666B2 (en) * | 2005-02-11 | 2014-02-25 | 3M Innovative Properties Company | Substituted imidazoquinolines and imidazonaphthyridines |
| US7968563B2 (en) | 2005-02-11 | 2011-06-28 | 3M Innovative Properties Company | Oxime and hydroxylamine substituted imidazo[4,5-c] ring compounds and methods |
| CA2598639A1 (en) * | 2005-02-23 | 2006-08-31 | Coley Pharmaceutical Group, Inc. | Hydroxyalkyl substituted imidazonaphthyridines |
| EP1850849A2 (de) * | 2005-02-23 | 2007-11-07 | Coley Pharmaceutical Group, Inc. | Verfahren zur vorzugsweisen herbeiführung der biosynthese von interferon |
| CA2598695A1 (en) * | 2005-02-23 | 2006-09-21 | Coley Pharmaceutical Group, Inc. | Hydroxyalkyl substituted imidazoquinolines |
| US8158794B2 (en) * | 2005-02-23 | 2012-04-17 | 3M Innovative Properties Company | Hydroxyalkyl substituted imidazoquinoline compounds and methods |
| AU2006223148A1 (en) * | 2005-03-14 | 2006-09-21 | 3M Innovative Properties Company | Method of treating actinic keratosis |
| EP1869043A2 (de) | 2005-04-01 | 2007-12-26 | Coley Pharmaceutical Group, Inc. | Pyrazolopyridin-1,4-diamine und analoge davon |
| AU2006232375A1 (en) | 2005-04-01 | 2006-10-12 | Coley Pharmaceutical Group, Inc. | 1-substituted pyrazolo (3,4-c) ring compounds as modulators of cytokine biosynthesis for the treatment of viral infections and neoplastic diseases |
| EP1863770A4 (de) * | 2005-04-01 | 2010-05-05 | Coley Pharm Group Inc | Ringschliessung sowie entsprechende verfahren und zwischenprodukte |
| JP2008539252A (ja) | 2005-04-25 | 2008-11-13 | スリーエム イノベイティブ プロパティズ カンパニー | 免疫活性化組成物 |
| JP2009507795A (ja) * | 2005-08-31 | 2009-02-26 | スミスクライン ビーチャム コーポレーション | 化合物 |
| ZA200803029B (en) * | 2005-09-09 | 2009-02-25 | Coley Pharm Group Inc | Amide and carbamate derivatives of alkyl substituted /V-[4-(4-amino-1H-imidazo[4,5-c] quinolin-1-yl)butyl] methane-sulfonamides and methods |
| US8476292B2 (en) * | 2005-09-09 | 2013-07-02 | 3M Innovative Properties Company | Amide and carbamate derivatives of N-{2-[4-amino-2-(ethoxymethyl)-1H-imidazo[4,5-c] quinolin-1-Yl]-1,1-dimethylethyl}methanesulfonamide and methods |
| US8889154B2 (en) | 2005-09-15 | 2014-11-18 | Medicis Pharmaceutical Corporation | Packaging for 1-(2-methylpropyl)-1H-imidazo[4,5-c] quinolin-4-amine-containing formulation |
| EP1948173B1 (de) | 2005-11-04 | 2013-07-17 | 3M Innovative Properties Company | Hydroxy- und alkoxy-substituierte 1h-imidazochinoline und verfahren |
| WO2007079086A1 (en) * | 2005-12-28 | 2007-07-12 | Coley Pharmaceutical Group, Inc. | Pyrazoloalkyl substituted imidazo ring compounds and methods |
| EP3085373A1 (de) | 2006-02-22 | 2016-10-26 | 3M Innovative Properties Company | Konjugate zur modifizierung von immunreaktionen |
| WO2007106852A2 (en) | 2006-03-15 | 2007-09-20 | Coley Pharmaceutical Group, Inc. | Substituted fused[1,2]imidazo[4,5-c] ring compounds and methods |
| WO2007106854A2 (en) * | 2006-03-15 | 2007-09-20 | Coley Pharmaceutical Group, Inc. | Hydroxy and alkoxy substituted 1h-imidazonaphthyridines and methods |
| WO2007109813A1 (en) | 2006-03-23 | 2007-09-27 | Novartis Ag | Imidazoquinoxaline compounds as immunomodulators |
| WO2007143526A2 (en) * | 2006-06-05 | 2007-12-13 | Coley Pharmaceutical Group, Inc. | Substituted tetrahydroimidazonaphthyridines and methods |
| US7906506B2 (en) | 2006-07-12 | 2011-03-15 | 3M Innovative Properties Company | Substituted chiral fused [1,2] imidazo [4,5-c] ring compounds and methods |
| NO343857B1 (no) * | 2006-07-18 | 2019-06-24 | Meda Ab | Immunresponsmodifiserende skumformuleringer |
| AU2007279376B2 (en) * | 2006-07-31 | 2012-09-06 | Wirra Ip Pty Ltd | Immune response modifier compositions and methods |
| US8178539B2 (en) * | 2006-09-06 | 2012-05-15 | 3M Innovative Properties Company | Substituted 3,4,6,7-tetrahydro-5H-1,2a,4a,8-tetraazacyclopenta[cd]phenalenes and methods |
| US20080149123A1 (en) * | 2006-12-22 | 2008-06-26 | Mckay William D | Particulate material dispensing hairbrush with combination bristles |
| CN101568351B (zh) * | 2006-12-22 | 2012-05-30 | 3M创新有限公司 | 控制释放的组合物和方法 |
| US20090018155A1 (en) | 2007-02-08 | 2009-01-15 | Gregory Jefferson J | Methods of treating dermatological disorders and inducing interferon biosynthesis with shorter durations of imiquimod therapy |
| US20100160368A1 (en) * | 2008-08-18 | 2010-06-24 | Gregory Jefferson J | Methods of Treating Dermatological Disorders and Inducing Interferon Biosynthesis With Shorter Durations of Imiquimod Therapy |
| MX346455B (es) | 2008-12-19 | 2017-03-21 | Medicis Pharmaceutical Corp | Formulaciones de imiquimod de baja concentracion de dosis y regimenes de dosis de corta duracion para tratar queratosis actinica. |
| AU2010229835B2 (en) | 2009-03-25 | 2015-01-15 | The Board Of Regents Of The University Of Texas System | Compositions for stimulation of mammalian innate immune resistance to pathogens |
| WO2010114898A1 (en) * | 2009-03-31 | 2010-10-07 | Arqule, Inc. | Substituted dipyrido-pyrimido-diazepine and benzo-pyrido-pyrimido compounds |
| US8511006B2 (en) * | 2009-07-02 | 2013-08-20 | Owens Corning Intellectual Capital, Llc | Building-integrated solar-panel roof element systems |
| MX336923B (es) * | 2009-07-13 | 2016-02-05 | Medicis Pharmaceutical Corp | Formulaciones de imiquimod de concentracion de dosificacion inferior y regimenes de dosificacion cortos para tratar verrugas genitales y perianales. |
| US20110033515A1 (en) * | 2009-08-04 | 2011-02-10 | Rst Implanted Cell Technology | Tissue contacting material |
| RU2012132278A (ru) * | 2010-01-12 | 2014-02-20 | Ф. Хоффманн-Ля Рош Аг | Трициклические гетероциклические соединения, содержащие их композиции и способы их применения |
| AU2011270724B2 (en) | 2010-06-25 | 2016-10-06 | Medicis Pharmaceutical Corporation | Combination therapy with cryosurgery and low dosage strength imiquimod to treat actinic keratosis |
| HUE033901T2 (en) | 2010-08-17 | 2018-01-29 | 3M Innovative Properties Co | Formulations and formulations for lipidized immune response modifying compounds and related processes |
| CA2838023C (en) | 2011-06-03 | 2019-08-13 | 3M Innovative Properties Company | Hydrazino 1h-imidazoquinolin-4-amines and conjugates made therefrom |
| JP6460789B2 (ja) | 2011-06-03 | 2019-01-30 | スリーエム イノベイティブ プロパティズ カンパニー | ポリエチレングリコールセグメントを有するヘテロ2官能性リンカー及び該リンカーから調製された免疫反応調節複合体 |
| US20130023736A1 (en) | 2011-07-21 | 2013-01-24 | Stanley Dale Harpstead | Systems for drug delivery and monitoring |
| WO2013040447A2 (en) | 2011-09-14 | 2013-03-21 | Medicis Pharmaceutical Corporation | Combination therapy with low dosage strength imiquimod and photodynamic therapy to treat actinic keratosis |
| CA2857664A1 (en) | 2011-11-30 | 2013-06-06 | Sarepta Therapeutics, Inc. | Antisense oligonucleotides targeting within the smn2 pre-mrna for use ininduced exon inclusion in spinal muscle atrophy |
| US10076535B2 (en) | 2012-04-27 | 2018-09-18 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Use of CPG oligonucleotides co-formulated with an antibiotic to accelerate wound healing |
| PE20142406A1 (es) | 2012-05-04 | 2015-01-23 | Pfizer | Antigenos asociados a prostata y regimenes de inmunoterapia basados en vacuna |
| CN112587671A (zh) | 2012-07-18 | 2021-04-02 | 博笛生物科技有限公司 | 癌症的靶向免疫治疗 |
| EP2941233B1 (de) | 2013-01-07 | 2020-10-07 | The Trustees of the University of Pennsylvania | Zusammensetzungen und verfahren zur behandlung von t-zelllymphom |
| EP3632458A1 (de) | 2013-07-26 | 2020-04-08 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Verbindungen und pharmazeutische zusammensetzungen zur behandlung von bakterieninfektionen |
| AU2014347059B2 (en) | 2013-11-05 | 2017-09-07 | Solventum Intellectual Properties Company | Sesame oil based injection formulations |
| EP3083618B1 (de) | 2013-12-17 | 2018-02-21 | Pfizer Inc | Neuartige 3,4-disubstituierte-1h-pyrrolo[2,3-b]pyridine und 4,5-disubstituierte 7h-pyrrolo[2,3-c]pyridazine als lrrk2-hemmer |
| WO2015103989A1 (en) | 2014-01-10 | 2015-07-16 | Shanghai Birdie Biotech, Inc. | Compounds and compositions for immunotherapy |
| CN112546231A (zh) | 2014-07-09 | 2021-03-26 | 博笛生物科技有限公司 | 用于治疗癌症的联合治疗组合物和联合治疗方法 |
| DK3166976T3 (da) | 2014-07-09 | 2022-04-11 | Birdie Biopharmaceuticals Inc | Anti-pd-l1-kombinationer til behandling af tumorer |
| CN112587672A (zh) | 2014-09-01 | 2021-04-02 | 博笛生物科技有限公司 | 用于治疗肿瘤的抗-pd-l1结合物 |
| WO2016180852A1 (en) | 2015-05-12 | 2016-11-17 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for preparing antigen-specific t cells from an umbilical cord blood sample |
| EP3298131B1 (de) | 2015-05-20 | 2023-04-26 | The Regents of The University of California | Verfahren zur erzeugung menschlicher dendritischer zellen zur immuntherapie |
| CN107922416B (zh) * | 2015-08-31 | 2021-07-02 | 3M创新有限公司 | 含有取代的胍基团的咪唑并[4,5-c]环化合物 |
| EP3344622B1 (de) | 2015-08-31 | 2021-07-07 | 3M Innovative Properties Company | Guanidinsubstituierte kondensierte 1h-imidazo[4,5-c]pyridin-verbindungen, die zur behandlung viraler und neoplastischer krankheiten verwendet werden können. |
| JP6873980B2 (ja) * | 2015-09-14 | 2021-05-19 | ファイザー・インク | LRRK2阻害薬としての新規のイミダゾ[4,5−c]キノリンおよびイミダゾ[4,5−c][1,5]ナフチリジン誘導体 |
| US10526309B2 (en) | 2015-10-02 | 2020-01-07 | The University Of North Carolina At Chapel Hill | Pan-TAM inhibitors and Mer/Axl dual inhibitors |
| CN106943596A (zh) | 2016-01-07 | 2017-07-14 | 博笛生物科技(北京)有限公司 | 用于治疗肿瘤的抗-cd20组合 |
| CN115252792A (zh) | 2016-01-07 | 2022-11-01 | 博笛生物科技有限公司 | 用于治疗肿瘤的抗-egfr组合 |
| CN115350279A (zh) | 2016-01-07 | 2022-11-18 | 博笛生物科技有限公司 | 用于治疗肿瘤的抗-her2组合 |
| JP6883806B2 (ja) * | 2016-03-09 | 2021-06-09 | 国立大学法人大阪大学 | 化合物、及びこれを含む有機半導体材料 |
| MX2018013640A (es) | 2016-05-16 | 2019-08-01 | Infectious Disease Res Inst | Liposomas pegiladas y metodos de uso. |
| CN109310773B (zh) | 2016-05-16 | 2022-04-26 | 传染病研究所 | 含有tlr激动剂的配制品和使用方法 |
| WO2018038877A1 (en) | 2016-08-26 | 2018-03-01 | 3M Innovative Properties Company | FUSED [1,2]IMIDAZO[4,5-c] RING COMPOUNDS SUBSTITUTED WITH GUANIDINO GROUPS |
| WO2018045058A1 (en) | 2016-08-30 | 2018-03-08 | Dana-Farber Cancer Institute, Inc. | Drug delivery compositions and uses thereof |
| AU2017356673B2 (en) | 2016-11-09 | 2023-11-09 | Pulmotect, Inc. | Methods and compositions for adaptive immune modulation |
| CN110072551B (zh) | 2016-12-14 | 2023-05-23 | 比奥拉治疗股份有限公司 | 使用利用可摄入装置释放的il-12/il-23抑制剂治疗胃肠道疾病 |
| CA3046019A1 (en) | 2016-12-14 | 2018-06-21 | Progenity Inc. | Treatment of a disease of the gastrointestinal tract with a tlr modulator |
| JP2020513280A (ja) | 2016-12-14 | 2020-05-14 | プロジェニティ, インコーポレイテッド | 消化管疾病の免疫抑制剤による治療 |
| KR20190097107A (ko) | 2016-12-14 | 2019-08-20 | 프로제너티, 인크. | Jak 저해제로의 위장관 질환의 치료 및 장치 |
| US11134889B2 (en) | 2016-12-14 | 2021-10-05 | Progenity, Inc. | Treatment of a disease of the gastrointestinal tract with a SMAD7 inhibitor |
| US10980739B2 (en) | 2016-12-14 | 2021-04-20 | Progenity, Inc. | Treatment of a disease of the gastrointestinal tract with a chemokine/chemokine receptor inhibitor |
| US10766896B2 (en) | 2017-03-01 | 2020-09-08 | 3M Innovative Properties Company | Imidazo[4,5-c] ring compounds containing guanidine substituted benzamide groups |
| CA3054156A1 (en) | 2017-03-30 | 2018-10-04 | Progenity Inc. | Treatment of a disease of the gastrointestinal tract with il-10 or an il-10 agonist |
| CN108794467A (zh) | 2017-04-27 | 2018-11-13 | 博笛生物科技有限公司 | 2-氨基-喹啉衍生物 |
| AR111760A1 (es) | 2017-05-19 | 2019-08-14 | Novartis Ag | Compuestos y composiciones para el tratamiento de tumores sólidos mediante administración intratumoral |
| CA3067268A1 (en) | 2017-06-23 | 2018-12-27 | Birdie Biopharmaceuticals, Inc. | Crystalline resiquimod monosulfate anhydrate and its preparation and uses |
| JP7386536B2 (ja) | 2017-08-22 | 2023-11-27 | ダイナヴァックス テクノロジーズ コーポレイション | アルキル鎖修飾イミダゾキノリンtlr7/8アゴニスト化合物およびその使用 |
| US10722591B2 (en) | 2017-11-14 | 2020-07-28 | Dynavax Technologies Corporation | Cleavable conjugates of TLR7/8 agonist compounds, methods for preparation, and uses thereof |
| US11306083B2 (en) | 2017-12-20 | 2022-04-19 | 3M Innovative Properties Company | Amide substituted imidazo[4,5-C]quinoline compounds with a branched chain linking group for use as an immune response modifier |
| EP3759107A1 (de) | 2018-02-28 | 2021-01-06 | 3M Innovative Properties Company | Substituierte imidazo[4,5-c]chinolin-verbindungen mit einer n-1-verzweigten gruppe |
| KR20200128116A (ko) | 2018-02-28 | 2020-11-11 | 화이자 인코포레이티드 | Il-15 변이체 및 이의 용도 |
| CA3100829A1 (en) | 2018-05-23 | 2019-11-28 | Pfizer Inc. | Antibodies specific for gucy2c and uses thereof |
| EP3797121A1 (de) | 2018-05-23 | 2021-03-31 | Pfizer Inc | Cd3-spezifische antikörper und verwendungen davon |
| US11884662B2 (en) | 2018-05-24 | 2024-01-30 | 3M Innovative Properties Company | N-1 branched cycloalkyl substituted imidazo[4,5-c]quinoline compounds, compositions, and methods |
| EP3887369A1 (de) | 2018-11-26 | 2021-10-06 | 3M Innovative Properties Company | N-1-verzweigte alkylethersubstituierte imidazo[4,5-c]chinolinverbindungen, zusammensetzungen und verfahren |
| US20220370606A1 (en) | 2018-12-21 | 2022-11-24 | Pfizer Inc. | Combination Treatments Of Cancer Comprising A TLR Agonist |
| WO2020245706A1 (en) | 2019-06-06 | 2020-12-10 | 3M Innovative Properties Company | N-1 branched alkyl substituted imidazo[4,5-c]quinoline compounds, compositions, and methods |
| US20220194935A1 (en) | 2019-06-12 | 2022-06-23 | 3M Innovative Properties Company | Phenethyl substituted imidazo[4,5-c]quinoline compounds with an n-1 branched group |
| WO2021116420A1 (en) | 2019-12-13 | 2021-06-17 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Use of tlr7 and/or tlr8 agonists for the treatment of leptospirosis |
| MX2022006578A (es) | 2019-12-17 | 2022-07-04 | Pfizer | Anticuerpos especificos para cd47, pd-l1 y sus usos. |
| WO2022009157A1 (en) | 2020-07-10 | 2022-01-13 | Novartis Ag | Lhc165 and spartalizumab combinations for treating solid tumors |
| JP2023533793A (ja) | 2020-07-17 | 2023-08-04 | ファイザー・インク | 治療用抗体およびそれらの使用 |
Family Cites Families (99)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3314941A (en) | 1964-06-23 | 1967-04-18 | American Cyanamid Co | Novel substituted pyridodiazepins |
| US3764681A (en) * | 1970-07-08 | 1973-10-09 | Lilly Co Eli | Certain tetrazolo-(1,5-a) quinoline compounds as fungus control agents |
| US3917624A (en) | 1972-09-27 | 1975-11-04 | Pfizer | Process for producing 2-amino-nicotinonitrile intermediates |
| IL73534A (en) * | 1983-11-18 | 1990-12-23 | Riker Laboratories Inc | 1h-imidazo(4,5-c)quinoline-4-amines,their preparation and pharmaceutical compositions containing certain such compounds |
| ZA848968B (en) | 1983-11-18 | 1986-06-25 | Riker Laboratories Inc | 1h-imidazo(4,5-c)quinolines and 1h-imidazo(4,5-c)quinolin-4-amines |
| US5238944A (en) | 1988-12-15 | 1993-08-24 | Riker Laboratories, Inc. | Topical formulations and transdermal delivery systems containing 1-isobutyl-1H-imidazo[4,5-c]quinolin-4-amine |
| US5756747A (en) | 1989-02-27 | 1998-05-26 | Riker Laboratories, Inc. | 1H-imidazo 4,5-c!quinolin-4-amines |
| US4929624A (en) | 1989-03-23 | 1990-05-29 | Minnesota Mining And Manufacturing Company | Olefinic 1H-imidazo(4,5-c)quinolin-4-amines |
| US5037986A (en) | 1989-03-23 | 1991-08-06 | Minnesota Mining And Manufacturing Company | Olefinic 1H-imidazo[4,5-c]quinolin-4-amines |
| NZ232740A (en) | 1989-04-20 | 1992-06-25 | Riker Laboratories Inc | Solution for parenteral administration comprising a 1h-imidazo(4,5-c) quinolin-4-amine derivative, an acid and a tonicity adjuster |
| US4988815A (en) | 1989-10-26 | 1991-01-29 | Riker Laboratories, Inc. | 3-Amino or 3-nitro quinoline compounds which are intermediates in preparing 1H-imidazo[4,5-c]quinolines |
| DK0553202T3 (da) | 1990-10-05 | 1995-07-03 | Minnesota Mining & Mfg | Fremgangsmåde til fremstilling af imidazo(4,5-c)quinolin-4-aminer |
| US5389640A (en) | 1991-03-01 | 1995-02-14 | Minnesota Mining And Manufacturing Company | 1-substituted, 2-substituted 1H-imidazo[4,5-c]quinolin-4-amines |
| US5175296A (en) | 1991-03-01 | 1992-12-29 | Minnesota Mining And Manufacturing Company | Imidazo[4,5-c]quinolin-4-amines and processes for their preparation |
| US5268376A (en) * | 1991-09-04 | 1993-12-07 | Minnesota Mining And Manufacturing Company | 1-substituted 1H-imidazo[4,5-c]quinolin-4-amines |
| US5378698A (en) * | 1991-10-21 | 1995-01-03 | Shionogi & Co., Ltd. | Benzothiazepine derivatives |
| US5266575A (en) | 1991-11-06 | 1993-11-30 | Minnesota Mining And Manufacturing Company | 2-ethyl 1H-imidazo[4,5-ciquinolin-4-amines |
| IL105325A (en) | 1992-04-16 | 1996-11-14 | Minnesota Mining & Mfg | Immunogen/vaccine adjuvant composition |
| US5395937A (en) | 1993-01-29 | 1995-03-07 | Minnesota Mining And Manufacturing Company | Process for preparing quinoline amines |
| CZ288182B6 (en) | 1993-07-15 | 2001-05-16 | Minnesota Mining & Mfg | Imidazo[4,5-c]pyridine-4-amines and pharmaceutical preparations based thereon |
| US5648516A (en) * | 1994-07-20 | 1997-07-15 | Minnesota Mining And Manufacturing Company | Fused cycloalkylimidazopyridines |
| US5352784A (en) | 1993-07-15 | 1994-10-04 | Minnesota Mining And Manufacturing Company | Fused cycloalkylimidazopyridines |
| US5644063A (en) | 1994-09-08 | 1997-07-01 | Minnesota Mining And Manufacturing Company | Imidazo[4,5-c]pyridin-4-amine intermediates |
| US5482936A (en) * | 1995-01-12 | 1996-01-09 | Minnesota Mining And Manufacturing Company | Imidazo[4,5-C]quinoline amines |
| US5585612A (en) | 1995-03-20 | 1996-12-17 | Harp Enterprises, Inc. | Method and apparatus for voting |
| JPH09208584A (ja) | 1996-01-29 | 1997-08-12 | Terumo Corp | アミド誘導体、およびそれを含有する医薬製剤、および合成中間体 |
| JPH09255926A (ja) | 1996-03-26 | 1997-09-30 | Diatex Co Ltd | 粘着テープ |
| US5741908A (en) | 1996-06-21 | 1998-04-21 | Minnesota Mining And Manufacturing Company | Process for reparing imidazoquinolinamines |
| US5693811A (en) | 1996-06-21 | 1997-12-02 | Minnesota Mining And Manufacturing Company | Process for preparing tetrahdroimidazoquinolinamines |
| CA2268957C (en) | 1996-10-25 | 2008-04-29 | Minnesota Mining And Manufacturing Company | Immune response modifier compounds for treatment of th2 mediated and related diseases |
| ES2179254T3 (es) * | 1996-11-04 | 2003-01-16 | Bayer Cropscience Sa | 1-poliarilpirazoles plaguicidas. |
| US5939090A (en) | 1996-12-03 | 1999-08-17 | 3M Innovative Properties Company | Gel formulations for topical drug delivery |
| EP0894797A4 (de) | 1997-01-09 | 2001-08-16 | Terumo Corp | Neue amidderivate und intermediate zu ihrer synthese |
| UA67760C2 (uk) * | 1997-12-11 | 2004-07-15 | Міннесота Майнінг Енд Мануфакчурінг Компані | Імідазонафтиридин та тетрагідроімідазонафтиридин, фармацевтична композиція, спосіб індукування біосинтезу цитокінів та спосіб лікування вірусної інфекції, проміжні сполуки |
| JPH11222432A (ja) | 1998-02-03 | 1999-08-17 | Terumo Corp | インターフェロンを誘起するアミド誘導体を含有する外用剤 |
| JPH11255926A (ja) | 1998-03-13 | 1999-09-21 | Toray Ind Inc | シリコーン成型品およびその製造方法 |
| US6110929A (en) | 1998-07-28 | 2000-08-29 | 3M Innovative Properties Company | Oxazolo, thiazolo and selenazolo [4,5-c]-quinolin-4-amines and analogs thereof |
| JP2000119271A (ja) | 1998-08-12 | 2000-04-25 | Hokuriku Seiyaku Co Ltd | 1h―イミダゾピリジン誘導体 |
| US6518280B2 (en) * | 1998-12-11 | 2003-02-11 | 3M Innovative Properties Company | Imidazonaphthyridines |
| US20020058674A1 (en) * | 1999-01-08 | 2002-05-16 | Hedenstrom John C. | Systems and methods for treating a mucosal surface |
| CN1555264A (zh) | 1999-01-08 | 2004-12-15 | 3M | 用于治疗粘膜病症的含咪喹莫特或其它免疫应答调节剂的制剂 |
| US6545485B1 (en) * | 1999-01-21 | 2003-04-08 | Radar Engineers | Ultrasonic pinpointer for power system sources of interference |
| US6558951B1 (en) | 1999-02-11 | 2003-05-06 | 3M Innovative Properties Company | Maturation of dendritic cells with immune response modifying compounds |
| JP2000247884A (ja) | 1999-03-01 | 2000-09-12 | Sumitomo Pharmaceut Co Ltd | アラキドン酸誘発皮膚疾患治療剤 |
| US6573273B1 (en) * | 1999-06-10 | 2003-06-03 | 3M Innovative Properties Company | Urea substituted imidazoquinolines |
| US6331539B1 (en) * | 1999-06-10 | 2001-12-18 | 3M Innovative Properties Company | Sulfonamide and sulfamide substituted imidazoquinolines |
| US6756382B2 (en) * | 1999-06-10 | 2004-06-29 | 3M Innovative Properties Company | Amide substituted imidazoquinolines |
| US6541485B1 (en) | 1999-06-10 | 2003-04-01 | 3M Innovative Properties Company | Urea substituted imidazoquinolines |
| US6451810B1 (en) | 1999-06-10 | 2002-09-17 | 3M Innovative Properties Company | Amide substituted imidazoquinolines |
| US6660260B1 (en) * | 1999-09-21 | 2003-12-09 | Mayo Foundation For Medical Education And Research | Bioprosthetic heart valves |
| US6376669B1 (en) | 1999-11-05 | 2002-04-23 | 3M Innovative Properties Company | Dye labeled imidazoquinoline compounds |
| US6894060B2 (en) | 2000-03-30 | 2005-05-17 | 3M Innovative Properties Company | Method for the treatment of dermal lesions caused by envenomation |
| US20020055517A1 (en) | 2000-09-15 | 2002-05-09 | 3M Innovative Properties Company | Methods for delaying recurrence of herpes virus symptoms |
| JP2002145777A (ja) | 2000-11-06 | 2002-05-22 | Sumitomo Pharmaceut Co Ltd | アラキドン酸誘発皮膚疾患治療剤 |
| US6660747B2 (en) * | 2000-12-08 | 2003-12-09 | 3M Innovative Properties Company | Amido ether substituted imidazoquinolines |
| US6660735B2 (en) * | 2000-12-08 | 2003-12-09 | 3M Innovative Properties Company | Urea substituted imidazoquinoline ethers |
| US6545016B1 (en) | 2000-12-08 | 2003-04-08 | 3M Innovative Properties Company | Amide substituted imidazopyridines |
| US6667312B2 (en) * | 2000-12-08 | 2003-12-23 | 3M Innovative Properties Company | Thioether substituted imidazoquinolines |
| UA75622C2 (en) * | 2000-12-08 | 2006-05-15 | 3M Innovative Properties Co | Aryl ether substituted imidazoquinolines, pharmaceutical composition based thereon |
| US6664264B2 (en) * | 2000-12-08 | 2003-12-16 | 3M Innovative Properties Company | Thioether substituted imidazoquinolines |
| EP1360486A2 (de) * | 2000-12-08 | 2003-11-12 | 3M Innovative Properties Company | Screeningverfahren zur identifizierung von selektiven interferon-alpha-induzierenden verbindungen |
| US6545017B1 (en) | 2000-12-08 | 2003-04-08 | 3M Innovative Properties Company | Urea substituted imidazopyridines |
| US6525064B1 (en) | 2000-12-08 | 2003-02-25 | 3M Innovative Properties Company | Sulfonamido substituted imidazopyridines |
| US6664260B2 (en) * | 2000-12-08 | 2003-12-16 | 3M Innovative Properties Company | Heterocyclic ether substituted imidazoquinolines |
| US6664265B2 (en) * | 2000-12-08 | 2003-12-16 | 3M Innovative Properties Company | Amido ether substituted imidazoquinolines |
| US6677347B2 (en) * | 2000-12-08 | 2004-01-13 | 3M Innovative Properties Company | Sulfonamido ether substituted imidazoquinolines |
| US6677348B2 (en) * | 2000-12-08 | 2004-01-13 | 3M Innovative Properties Company | Aryl ether substituted imidazoquinolines |
| UA74593C2 (en) | 2000-12-08 | 2006-01-16 | 3M Innovative Properties Co | Substituted imidazopyridines |
| JP2005519849A (ja) | 2001-06-15 | 2005-07-07 | スリーエム イノベイティブ プロパティズ カンパニー | 歯周病の治療用免疫応答調節剤 |
| US20030133913A1 (en) * | 2001-08-30 | 2003-07-17 | 3M Innovative Properties Company | Methods of maturing plasmacytoid dendritic cells using immune response modifier molecules |
| US6667347B2 (en) * | 2001-09-14 | 2003-12-23 | Chevron U.S.A. Inc. | Scrubbing CO2 from methane-containing gases using an aqueous stream |
| AU2002360278A1 (en) * | 2001-10-12 | 2003-11-11 | Coley Pharmaceutical Gmbh | Methods and products for enhancing immune responses using imidazoquinoline compounds |
| DK1719511T3 (da) * | 2001-11-16 | 2009-04-14 | Coley Pharm Group Inc | N-[4-(4-amino-2-ethyl-1H-imidazo[4,5-c]quinolin-1-yl)butyl]methansulfonamid, en farmaceutisk sammensætning omfattende samme, og anvendelse deraf |
| ES2312659T3 (es) * | 2001-11-29 | 2009-03-01 | 3M Innovative Properties Company | Formulaciones farmaceuticas que comprenden un modificador de la respuesta inmune. |
| US6677349B1 (en) * | 2001-12-21 | 2004-01-13 | 3M Innovative Properties Company | Sulfonamide and sulfamide substituted imidazoquinolines |
| JP2005518433A (ja) * | 2002-02-22 | 2005-06-23 | スリーエム イノベイティブ プロパティズ カンパニー | Uvb−誘導免疫抑制を軽減し治療する方法 |
| GB0211649D0 (en) | 2002-05-21 | 2002-07-03 | Novartis Ag | Organic compounds |
| AU2003233519A1 (en) * | 2002-05-29 | 2003-12-19 | 3M Innovative Properties Company | Process for imidazo(4,5-c)pyridin-4-amines |
| JP2005538057A (ja) * | 2002-06-07 | 2005-12-15 | スリーエム イノベイティブ プロパティズ カンパニー | エーテル置換イミダゾピリジン |
| AU2003299863B2 (en) * | 2002-08-15 | 2009-09-24 | 3M Innovative Properties Company | Immunostimulatory compositions and methods of stimulating an immune response |
| AU2003299082A1 (en) * | 2002-09-26 | 2004-04-19 | 3M Innovative Properties Company | 1h-imidazo dimers |
| EP1572236A4 (de) * | 2002-11-14 | 2007-01-03 | Pintex Pharmaceuticals Inc | Pin1-spiegel in normalem gewebe sowie in krebsgewebe |
| AU2003287324A1 (en) * | 2002-12-11 | 2004-06-30 | 3M Innovative Properties Company | Gene expression systems and recombinant cell lines |
| AU2003287316A1 (en) * | 2002-12-11 | 2004-06-30 | 3M Innovative Properties Company | Assays relating to toll-like receptor activity |
| AU2003301052A1 (en) * | 2002-12-20 | 2004-07-22 | 3M Innovative Properties Company | Aryl / hetaryl substituted imidazoquinolines |
| US7387271B2 (en) * | 2002-12-30 | 2008-06-17 | 3M Innovative Properties Company | Immunostimulatory combinations |
| WO2004071459A2 (en) * | 2003-02-13 | 2004-08-26 | 3M Innovative Properties Company | Methods and compositions related to irm compounds and toll-like receptor 8 |
| US7485432B2 (en) * | 2003-02-27 | 2009-02-03 | 3M Innovative Properties Company | Selective modulation of TLR-mediated biological activity |
| AU2004218349A1 (en) * | 2003-03-04 | 2004-09-16 | 3M Innovative Properties Company | Prophylactic treatment of UV-induced epidermal neoplasia |
| CA2517655A1 (en) * | 2003-03-07 | 2004-09-23 | 3M Innovative Properties Company | 1-amino 1h-imidazoquinolines |
| MXPA05009694A (es) * | 2003-03-13 | 2005-10-20 | 3M Innovative Properties Co | Metodos para mejorar la calidad de la piel. |
| WO2004080293A2 (en) * | 2003-03-13 | 2004-09-23 | 3M Innovative Properties Company | Methods for diagnosing skin lesions |
| CA2518445A1 (en) * | 2003-03-13 | 2004-09-23 | 3M Innovative Properties Company | Method of tattoo removal |
| WO2004087049A2 (en) * | 2003-03-25 | 2004-10-14 | 3M Innovative Properties Company | Selective activation of cellular activities mediated through a common toll-like receptor |
| US20040192585A1 (en) * | 2003-03-25 | 2004-09-30 | 3M Innovative Properties Company | Treatment for basal cell carcinoma |
| AU2004244962A1 (en) * | 2003-04-10 | 2004-12-16 | 3M Innovative Properties Company | Delivery of immune response modifier compounds using metal-containing particulate support materials |
| EP1617845A4 (de) * | 2003-04-28 | 2006-09-20 | 3M Innovative Properties Co | Zusammensetzungen und verfahren zur induktion von opioid-rezeptoren |
| US7576068B2 (en) * | 2003-09-05 | 2009-08-18 | Anadys Pharmaceuticals, Inc. | Administration of TLR7 ligands and prodrugs thereof for treatment of infection by hepatitis C virus |
| CA2592897A1 (en) * | 2004-12-30 | 2006-07-13 | Takeda Pharmaceutical Company Limited | 1-(2-methylpropyl)-1h-imidazo[4,5-c][1,5]naphthyridin-4-amine ethanesulfonate and 1-(2-methylpropyl)-1h-imidazo[4,5-c][1,5]naphthyridin-4-amine methanesulfonate |
-
1998
- 1998-11-12 UA UA2000074070A patent/UA67760C2/uk unknown
- 1998-12-11 HU HU0101155A patent/HUP0101155A3/hu unknown
- 1998-12-11 WO PCT/US1998/026473 patent/WO1999029693A1/en active Application Filing
- 1998-12-11 BR BR9814275-5A patent/BR9814275A/pt not_active IP Right Cessation
- 1998-12-11 SK SK835-2000A patent/SK285872B6/sk not_active IP Right Cessation
- 1998-12-11 RU RU2000114496/04A patent/RU2221798C2/ru active
- 1998-12-11 EE EEP200000349A patent/EE04314B1/xx not_active IP Right Cessation
- 1998-12-11 PL PL98341159A patent/PL193915B1/pl not_active IP Right Cessation
- 1998-12-11 RU RU2003126258/04A patent/RU2314307C2/ru active
- 1998-12-11 KR KR1020007006369A patent/KR100642703B1/ko not_active IP Right Cessation
- 1998-12-11 IL IL13655698A patent/IL136556A0/xx active IP Right Grant
- 1998-12-11 US US09/210,114 patent/US6194425B1/en not_active Expired - Fee Related
- 1998-12-11 SK SK5035-2007A patent/SK286304B6/sk not_active IP Right Cessation
- 1998-12-11 EP EP98963888A patent/EP1040112B1/de not_active Expired - Lifetime
- 1998-12-11 CZ CZ2007-268A patent/CZ307184B6/cs not_active IP Right Cessation
- 1998-12-11 DE DE69826518T patent/DE69826518T2/de not_active Expired - Fee Related
- 1998-12-11 RU RU2003126259/04A patent/RU2312867C2/ru not_active IP Right Cessation
- 1998-12-11 NZ NZ504776A patent/NZ504776A/en unknown
- 1998-12-11 ES ES04022441T patent/ES2273138T3/es not_active Expired - Lifetime
- 1998-12-11 AT AT98963888T patent/ATE277046T1/de not_active IP Right Cessation
- 1998-12-11 DE DE69835309T patent/DE69835309T2/de not_active Expired - Lifetime
- 1998-12-11 DK DK04022441T patent/DK1512686T3/da active
- 1998-12-11 TR TR2000/01705T patent/TR200001705T2/xx unknown
- 1998-12-11 DE DE69835844T patent/DE69835844T2/de not_active Expired - Fee Related
- 1998-12-11 CN CNB988135639A patent/CN1154647C/zh not_active Expired - Fee Related
- 1998-12-11 PT PT04022440T patent/PT1512685E/pt unknown
- 1998-12-11 AT AT04022440T patent/ATE333456T1/de active
- 1998-12-11 CA CA2311456A patent/CA2311456C/en not_active Expired - Lifetime
- 1998-12-11 SI SI9830868T patent/SI1512686T1/sl unknown
- 1998-12-11 ES ES98963888T patent/ES2227902T3/es not_active Expired - Lifetime
- 1998-12-11 AT AT04022441T patent/ATE338757T1/de not_active IP Right Cessation
- 1998-12-11 JP JP2000524286A patent/JP4283438B2/ja not_active Expired - Fee Related
- 1998-12-11 KR KR1020037016102A patent/KR100642702B1/ko not_active IP Right Cessation
- 1998-12-11 ES ES04022440T patent/ES2270249T3/es not_active Expired - Lifetime
- 1998-12-11 AU AU19123/99A patent/AU753864B2/en not_active Ceased
- 1998-12-11 KR KR1020037016103A patent/KR100563175B1/ko not_active IP Right Cessation
- 1998-12-11 PT PT04022441T patent/PT1512686E/pt unknown
- 1998-12-11 PT PT98963888T patent/PT1040112E/pt unknown
-
2000
- 2000-05-24 NO NO20002663A patent/NO316687B1/no not_active IP Right Cessation
- 2000-06-02 HR HR20000363A patent/HRP20000363B1/xx not_active IP Right Cessation
- 2000-06-05 IL IL136556A patent/IL136556A/en not_active IP Right Cessation
- 2000-11-06 US US09/706,990 patent/US6514985B1/en not_active Expired - Fee Related
-
2001
- 2001-08-31 US US09/945,197 patent/US6624172B2/en not_active Expired - Lifetime
-
2002
- 2002-06-27 US US10/185,387 patent/US6693113B2/en not_active Expired - Lifetime
- 2002-06-27 US US10/184,304 patent/US6638944B2/en not_active Expired - Fee Related
- 2002-10-07 US US10/265,956 patent/US6699878B2/en not_active Expired - Fee Related
-
2003
- 2003-04-02 US US10/405,321 patent/US6747040B2/en not_active Expired - Fee Related
- 2003-04-03 US US10/406,181 patent/US6797716B2/en not_active Expired - Lifetime
- 2003-12-19 NO NO20035719A patent/NO20035719D0/no unknown
- 2003-12-19 NO NO20035718A patent/NO328045B1/no not_active IP Right Cessation
-
2004
- 2004-04-14 US US10/824,232 patent/US6894165B2/en not_active Expired - Fee Related
- 2004-12-03 US US11/004,674 patent/US6949646B2/en not_active Expired - Lifetime
-
2005
- 2005-04-21 HK HK05103436A patent/HK1070655A1/xx not_active IP Right Cessation
- 2005-07-25 US US11/188,418 patent/US7038051B2/en not_active Expired - Lifetime
- 2005-12-12 JP JP2005358302A patent/JP4203067B2/ja not_active Expired - Fee Related
-
2006
- 2006-02-13 US US11/276,074 patent/US7335773B2/en not_active Expired - Fee Related
- 2006-09-14 IL IL178092A patent/IL178092A/en not_active IP Right Cessation
- 2006-09-14 IL IL178091A patent/IL178091A/en not_active IP Right Cessation
-
2007
- 2007-03-28 US US11/692,701 patent/US20070167481A1/en not_active Abandoned
- 2007-07-11 JP JP2007181872A patent/JP2007262093A/ja not_active Withdrawn
- 2007-12-06 US US11/999,602 patent/US7678918B2/en not_active Expired - Fee Related
- 2007-12-26 JP JP2007335120A patent/JP2008115190A/ja active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69835309T2 (de) | Imidazonaphthyridinderivate und ihre verwendung zur induzierung von biosythese von cytokin | |
| DE60117859T2 (de) | HARNSTOFFSUBSTITUIERTE IMIDAZOCHINOLINETHER und Arzneimittel, die diese umfassen. | |
| DE69911622T2 (de) | Oxazolo, thiazolo und selenazolo [4,5-c]-chinolin-4-amine und derivate davon | |
| DE60029956T2 (de) | Amid-substituierte Imidazochinoline | |
| DE60030126T2 (de) | Sulfonamid- und sulfamid-substituierte imidazochinoline | |
| DE60030293T2 (de) | Harnstoffsubstituierte imidazochinoline | |
| US6545017B1 (en) | Urea substituted imidazopyridines | |
| US6545016B1 (en) | Amide substituted imidazopyridines | |
| US6518280B2 (en) | Imidazonaphthyridines | |
| US6660735B2 (en) | Urea substituted imidazoquinoline ethers | |
| US20020107262A1 (en) | Substituted imidazopyridines | |
| JP2004525868A (ja) | 置換イミダゾピリジン類 | |
| EP1512686B1 (de) | Imidazonaphthyridine und ihre verwendung zur induzierung der biosynthese von cytokin | |
| CZ20002158A3 (cs) | Imidazonaftyridiny a jejich použití při indukci biosyntézy cytokinu |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8327 | Change in the person/name/address of the patent owner |
Owner name: MEDA AB, SOLNA, SE |
|
| 8328 | Change in the person/name/address of the agent |
Representative=s name: VOSSIUS & PARTNER, 81675 MUENCHEN |