WO1998022521A1 - Polymerisierbare massen auf der basis von epoxiden - Google Patents
Polymerisierbare massen auf der basis von epoxiden Download PDFInfo
- Publication number
- WO1998022521A1 WO1998022521A1 PCT/EP1997/006504 EP9706504W WO9822521A1 WO 1998022521 A1 WO1998022521 A1 WO 1998022521A1 EP 9706504 W EP9706504 W EP 9706504W WO 9822521 A1 WO9822521 A1 WO 9822521A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- bis
- propanediyl
- epoxycyclohexyl
- methanediyl
- tris
- Prior art date
Links
- LGRHBRLGPAFHPB-UHFFFAOYSA-N CCC1OCC(CC[N](C)(C)O)C=CC1 Chemical compound CCC1OCC(CC[N](C)(C)O)C=CC1 LGRHBRLGPAFHPB-UHFFFAOYSA-N 0.000 description 1
- FYFAOICZDKDAQC-UHFFFAOYSA-N C[N](C)(CCC1CC2OC2CC1)OC Chemical compound C[N](C)(CCC1CC2OC2CC1)OC FYFAOICZDKDAQC-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic System
- C07F7/02—Silicon compounds
- C07F7/21—Cyclic compounds having at least one ring containing silicon, but no carbon in the ring
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K6/00—Preparations for dentistry
- A61K6/20—Protective coatings for natural or artificial teeth, e.g. sealings, dye coatings or varnish
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K6/00—Preparations for dentistry
- A61K6/30—Compositions for temporarily or permanently fixing teeth or palates, e.g. primers for dental adhesives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K6/00—Preparations for dentistry
- A61K6/80—Preparations for artificial teeth, for filling teeth or for capping teeth
- A61K6/884—Preparations for artificial teeth, for filling teeth or for capping teeth comprising natural or synthetic resins
- A61K6/891—Compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K6/00—Preparations for dentistry
- A61K6/80—Preparations for artificial teeth, for filling teeth or for capping teeth
- A61K6/884—Preparations for artificial teeth, for filling teeth or for capping teeth comprising natural or synthetic resins
- A61K6/891—Compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds
- A61K6/893—Polyurethanes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K6/00—Preparations for dentistry
- A61K6/80—Preparations for artificial teeth, for filling teeth or for capping teeth
- A61K6/884—Preparations for artificial teeth, for filling teeth or for capping teeth comprising natural or synthetic resins
- A61K6/891—Compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds
- A61K6/896—Polyorganosilicon compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic System
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/0834—Compounds having one or more O-Si linkage
- C07F7/0838—Compounds with one or more Si-O-Si sequences
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G59/00—Polycondensates containing more than one epoxy group per molecule; Macromolecules obtained by polymerising compounds containing more than one epoxy group per molecule using curing agents or catalysts which react with the epoxy groups
- C08G59/18—Macromolecules obtained by polymerising compounds containing more than one epoxy group per molecule using curing agents or catalysts which react with the epoxy groups ; e.g. general methods of curing
- C08G59/20—Macromolecules obtained by polymerising compounds containing more than one epoxy group per molecule using curing agents or catalysts which react with the epoxy groups ; e.g. general methods of curing characterised by the epoxy compounds used
- C08G59/22—Di-epoxy compounds
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G59/00—Polycondensates containing more than one epoxy group per molecule; Macromolecules obtained by polymerising compounds containing more than one epoxy group per molecule using curing agents or catalysts which react with the epoxy groups
- C08G59/18—Macromolecules obtained by polymerising compounds containing more than one epoxy group per molecule using curing agents or catalysts which react with the epoxy groups ; e.g. general methods of curing
- C08G59/20—Macromolecules obtained by polymerising compounds containing more than one epoxy group per molecule using curing agents or catalysts which react with the epoxy groups ; e.g. general methods of curing characterised by the epoxy compounds used
- C08G59/22—Di-epoxy compounds
- C08G59/24—Di-epoxy compounds carbocyclic
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G59/00—Polycondensates containing more than one epoxy group per molecule; Macromolecules obtained by polymerising compounds containing more than one epoxy group per molecule using curing agents or catalysts which react with the epoxy groups
- C08G59/18—Macromolecules obtained by polymerising compounds containing more than one epoxy group per molecule using curing agents or catalysts which react with the epoxy groups ; e.g. general methods of curing
- C08G59/20—Macromolecules obtained by polymerising compounds containing more than one epoxy group per molecule using curing agents or catalysts which react with the epoxy groups ; e.g. general methods of curing characterised by the epoxy compounds used
- C08G59/22—Di-epoxy compounds
- C08G59/30—Di-epoxy compounds containing atoms other than carbon, hydrogen, oxygen and nitrogen
- C08G59/306—Di-epoxy compounds containing atoms other than carbon, hydrogen, oxygen and nitrogen containing silicon
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G59/00—Polycondensates containing more than one epoxy group per molecule; Macromolecules obtained by polymerising compounds containing more than one epoxy group per molecule using curing agents or catalysts which react with the epoxy groups
- C08G59/18—Macromolecules obtained by polymerising compounds containing more than one epoxy group per molecule using curing agents or catalysts which react with the epoxy groups ; e.g. general methods of curing
- C08G59/20—Macromolecules obtained by polymerising compounds containing more than one epoxy group per molecule using curing agents or catalysts which react with the epoxy groups ; e.g. general methods of curing characterised by the epoxy compounds used
- C08G59/32—Epoxy compounds containing three or more epoxy groups
- C08G59/3218—Carbocyclic compounds
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G59/00—Polycondensates containing more than one epoxy group per molecule; Macromolecules obtained by polymerising compounds containing more than one epoxy group per molecule using curing agents or catalysts which react with the epoxy groups
- C08G59/18—Macromolecules obtained by polymerising compounds containing more than one epoxy group per molecule using curing agents or catalysts which react with the epoxy groups ; e.g. general methods of curing
- C08G59/20—Macromolecules obtained by polymerising compounds containing more than one epoxy group per molecule using curing agents or catalysts which react with the epoxy groups ; e.g. general methods of curing characterised by the epoxy compounds used
- C08G59/32—Epoxy compounds containing three or more epoxy groups
- C08G59/3254—Epoxy compounds containing three or more epoxy groups containing atoms other than carbon, hydrogen, oxygen or nitrogen
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L63/00—Compositions of epoxy resins; Compositions of derivatives of epoxy resins
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/038—Macromolecular compounds which are rendered insoluble or differentially wettable
Definitions
- the invention relates to polymerizable compositions based on epoxides, new cycloaliphatic epoxides and their use.
- methacrylate and acrylate monomers have predominantly been used in polymerizable dental materials. Particular attention should be paid to the 2,2-bis [4, l-phenyleneoxy (2-hydroxy-3, 1-propanediyl) methacrylic acid ester] - propylidene (bis-GMA) described by Bowen [US-A-3 066 112 ]. Mixtures of this methacrylate with triethylene glycol dimethacrylate are still used today as a standard formulation for dental plastic direct filling materials. Methacrylic derivatives of the double-formylated bis- (hydroxymethyl) tricyclo [5.2.1.0 2,6 ] - decane have also proven themselves as monomers for dental coposites [.
- a major disadvantage of the known polymerizable dental materials is the polymerization shrinkage, which can cause secondary caries, for example, when used as a filling material due to the formation of marginal gaps. Furthermore, in the case of dental compositions based on acrylate, the polymerization inhibition by oxygen leads to the formation of a so-called smear layer, which is undesirable, even harmful, for example in the case of fillings. Finally, polymerizable dental materials based on acrylate have little adhesion to the tooth substance.
- Silicon-containing cycloaliphatic epoxides were developed by Crivello et al. described in various publications (EP-A-0 449 027; J. Poly. Sei., Part A: Polym. réelle., 28 (1990) 479, ibid. 31 (1993) 2563; ibid. 31 (1993) 2729; ibid. 31 (1993) 3109; ibid. 31 (1993) 3121; ibid. 33 (1995) 2463).
- the known cycloaliphatic epoxides are essentially low-molecular monomers which, although having a somewhat reduced polymerization shrinkage [J. Adhes. Be. Technol. 9 (10) 1995, 1343; DE-A-4 340 949], but because of their high functional density they do not meet the requirements (processing, physical properties) for dental applications.
- the object of the present invention is to provide polymerizable compositions which, in comparison to the known ones Masses in addition to high reactivity and the necessary mechanical properties have a low volume shrinkage and have no mutagenic and only low cyctotoxic properties.
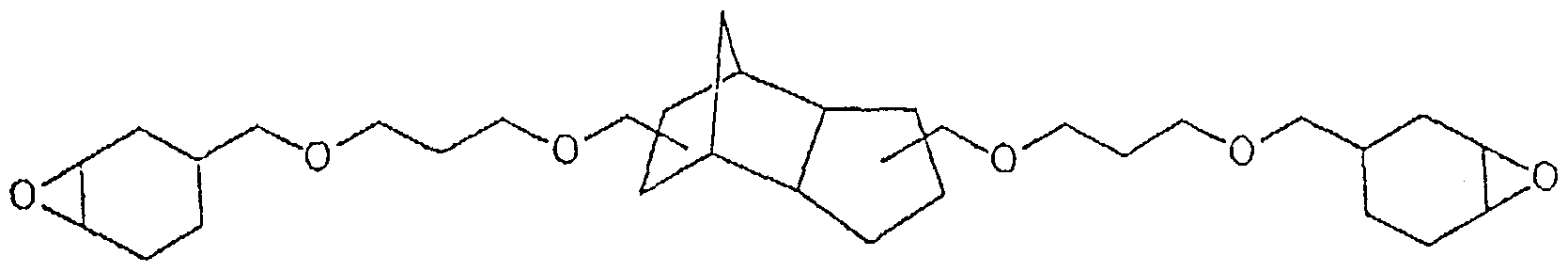
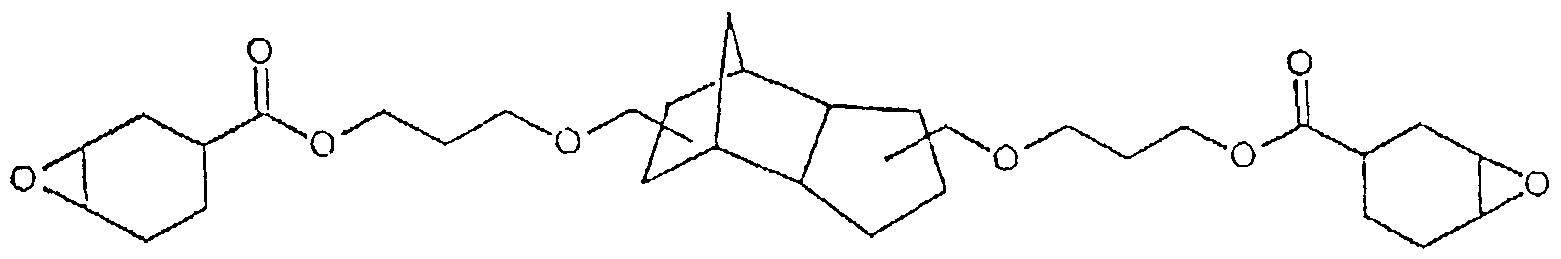
- compositions according to the invention contain, as component (a), one or more of the epoxides listed below:
- the invention also relates to the aforementioned, individually listed new cycloaliphatic epoxides per se.
- the epoxies can be produced in a simple manner.
- type A epoxides without siloxanyl units the cycloaliphatic alkenes obtained with conventional etherification or esterification of di-, tri- or polyols with cyclohexenecarboxylic acid or cyclohexenylmethanol are used with perbenzoic acid in a suitable solvent, preferably in diethyl ether , epoxidized. After the reaction has ended, the mixture is washed several times with sodium hydroxide solution and dried over magnesium sulfate. The volatile constituents are distilled off in vacuo.
- Type A epoxies with siloxanyl units can be produced by two-stage, classic hydrosilylation: an excess of a siloxane with at least two active hydrogen atoms and catalytic amounts of H 2 PtCl 6 dissolved in a suitable solvent (eg hexane) Compounds with two, three or more terminal alkene functions added. After the reaction has ended, the mixture is freed from precipitated platinum, washed once with water and dried over magnesium sulfate.
- a suitable solvent eg hexane
- the di-, tri- or polysiloxane-containing compound obtained is dissolved in a suitable solvent, for example in toluene or alkanes, and heated with H PtCl 6 and vinylcyclohexene epoxide.
- a suitable solvent for example in toluene or alkanes
- H PtCl 6 and vinylcyclohexene epoxide The mixture is freed from precipitated platinum and washed once with water.
- the product is obtained by distilling off the volatile constituents in vacuo.
- O 2,4 ] octanyl units are di-, tri- or poly (meth) acrylates with substituted (or unsubstituted) monomeric cyclopentadiene, thiophenes or furans under Lewis acid catalysis (for example ZnCl 2 or A1C1 3 ) Normal pressure or in an autoclave to the corresponding Diels-Alder products.
- Lewis acid catalysis for example ZnCl 2 or A1C1 3
- the endocyclic double bond is epoxidized with perbenzoic acid in a suitable solvent, preferably in diethyl ether. After the reaction has ended, the mixture is washed several times with sodium hydroxide solution and dried over magnesium sulfate. The volatile constituents are distilled off in vacuo.
- the polymerizable compositions according to the invention can contain other, low-viscosity epoxides as component (b).
- Low-viscosity epoxides according to (b) can be, for example: 3,4-epoxycyclohexylmethyl-3,4-epoxycyclohexane carboxylate (US Pat. No.
- siloxanes which are functionalized with cycloaliphatic epoxides, for example 1,1,3,3-tetramethyl-1,3-bis (ethanediyl-3,4,4-epoxycyclohexyl) disiloxane (EP-A-0 449 027, EP-A- 0 574 265) of the following formula:
- the low-viscosity epoxides according to component (b) are present in a concentration of 0 to 80 parts by weight, preferably 5 to 75 parts by weight, in each case based on the total weight of the composition.
- Inorganic fillers according to component (c) can be conventional dental fillers, for example quartz, ground optionally X-ray-opaque, optionally reactive glasses, poorly soluble fluorides, such as CaF 2 , YF 3 (EP-B-0 238 025), silica gels and pyrogenic silica or their granules his.
- one or more water-soluble inorganic complex fluorides of the general formula A n MF m where A is a mono- or polyvalent cation, M is a metal of the III, IV or V main or subgroup, n is an integer from 1 to 3 and an integer from 4 to 6 (DE-A-4 445 266) may be contained as fluoride-releasing constituents.
- Typical hydrophobizing agents are silanes, for example trimethoxyglycidylsilane.
- the maximum grain size of the inorganic fillers is preferably 20 ⁇ m, in particular 12 ⁇ m. Fillers with an average grain size of ⁇ 7 ⁇ m are very particularly preferably used.
- Initiators according to component (d) of the compositions according to the invention can be: Lewis or Broensted acids or compounds which release those acids which initiate the polymerization, for example BF 3 or its ethereal adducts (BF 3 -THF, BF 3 - Et 2 0, etc.), A1C1 3 , FeCl 3 , HPF 6 , HAsF 6 , HSbF 6 , HBF 4 or substances that trigger the polymerization after exposure to UV or visible light or by heat and / or pressure, such as ( eta-6-Cumol) (eta-5-cyclopentadienyl) iron hexafluorophosphate, (eta-6-cumene) (eta-5-cyclopentadienyl) iron tetrafluorobroat, (eta-6-cumene) (eta-5-cyclopentadienyl ) iron hexafluoroanti- month, substituted diaryliodonium
- Peroxy compounds of the perester, diacyl peroxide, peroxydicarbonate and hydroperoxide type can be used as accelerators.
- Hydroperoxides are preferably used; cumene hydroperoxide in an approximately 70 to 90 liter solution in cumene is used as a particularly preferred accelerator.
- the ratio of photoinitiator to cumene hydroperoxide can be varied within wide limits from 1: 0.001 to 1:10, but a ratio of 1: 0.1 to 1: 6 and particularly preferably from 1: 0.5 to 1: is preferred. 4 used.
- the use of complexing agents such as oxalic acid, 8-hydroxyquinoline, ethylenediaminetetraacetic acid and aromatic polyhydroxy compounds is also possible.
- Bases typically tertiary amines, can be added as retarders.
- Component (d) is in the composition according to the invention in an amount of 0.01 up to 25 parts by weight, preferably 0.01 to 20 parts by weight, based on the total weight of the mass.
- Suitable auxiliaries according to component (e) can be, for example, stabilizers, pigments or diluents customarily used in the dental field.
- the epoxy-containing, polymerizable compositions according to the invention are particularly suitable as materials for dental purposes, for example for the production of plastic teeth or temporary restorations, as coating agents, for bonding substrates and as dental filling materials.
- the polymerizable compositions according to the invention offer a particular advantage in dental applications.
- the volume shrinkage of the compositions according to the invention is far below the shrinkage of the known compositions based on methacrylate monomers. In this way, for example, the marginal gap problem with filling materials can be largely avoided.
- compositions according to the invention show a hardening which proceeds uniformly over a period of, for example, 10 to 240 seconds. Tensions within the resulting polymers are thus avoided.
- the compositions according to the invention therefore also have an optimal processing time before they reach their final hardness.
- the polymerizable compositions according to the invention exhibit surprisingly high Toughness, which is extremely important for dental applications.
- the dental filling materials according to the invention also show surprisingly good adhesion to the tooth substance. Furthermore, the epoxides according to the invention are not mutagenic and are harmless with regard to their cytotoxicity.
- the bis (tetramethyl-disiloxanylpropoxymethyl) tricyclof 5.2.1.0 2,6 ] decane obtained is dissolved in 200 ml of hexane, 120 mg of H 2 PtCl 6 and 71 g of vinyl-3,4-cyclohexene epoxide are added and the mixture is heated to 85 ° C. for 3 hours . The mixture is freed from precipitated platinum, washed once with water and dried over magnesium sulfate.
- the preparation of the one-component compositions which can be polymerized according to the invention is a two-stage process in which the first stage is a homogeneous premixing of all constituents with the exception of the photoinitiator. In a second stage, the photoinitiator is kneaded homogeneously into the paste with the exclusion of light. After the processable epoxy resins according to the invention thus obtained have been mixed in completely, they are filled into opaque containers.
- the two-component compositions which can be polymerized according to the invention are produced by first preparing a homogeneously mixed component A, consisting of the epoxy monomers, a filler fraction, the retarders, accelerators and the auxiliaries. Furthermore, a homogeneously mixed component B is produced, consisting of the initiator, diluent and a further filler fraction. Components A and B are filled, for example, in a double cartridge system. The two-component mass can be processed directly using a static mixer on the cartridge system.
- Component A From 17.6 parts by weight, ⁇ -bis- (3-propanediyl-3,5,7-tris (2, l-ethanediyl-3, 4-epoxycyclohexyl) - 1,3,5, 7-tetramethylcyclotetrasiloxanyl) -ditetrahydrofuran, 17.6 parts by weight of 3, 4-epoxycyclohexylmethyl-3, 4-epoxycyclohexane carboxylate and 64.7 parts by weight of a silanized, pigmented quartz are kneaded into a paste.
- a second component B consists of 32.8 parts by weight of polyethylene glycol, 4.7 parts by weight of BF 3 * OEt 2 and 62.5 parts by weight of a silanized, pigmented quartz. Pastes A and B are mixed in a 2: 1 ratio using a static mixer. The mass hardens within two minutes.
- 3,4-epoxycyclohexyl] propane 4.5 parts by weight 3,4-epoxycyclohexylmethyl-3,4-epoxycyclohexane carboxylate, 5.2 parts by weight 1,3,5,7-tetrakis (2,1- ethanediyl-3, 4-epoxycyclohexyl) -1,3,5, 7-tetramethylcyclotetrasiloxane, 70.5 parts by weight of a silanized pigmented quartz,
- Parts by weight of cumene hydroperoxide are kneaded to a paste, which is irradiated with a lamp (light advises Elipar II, ESPE Dental-Medizin GmbH & Co. KG, Germany) in about 40 seconds.
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Polymers & Plastics (AREA)
- Medicinal Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Epidemiology (AREA)
- Plastic & Reconstructive Surgery (AREA)
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- General Physics & Mathematics (AREA)
- Epoxy Resins (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Polymers With Sulfur, Phosphorus Or Metals In The Main Chain (AREA)
- Dental Preparations (AREA)
Abstract
Description
Claims
Priority Applications (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AT97951256T ATE215575T1 (de) | 1996-11-21 | 1997-11-21 | Polymerisierbare massen auf der basis von epoxiden |
| AU54849/98A AU719390B2 (en) | 1996-11-21 | 1997-11-21 | Polymerizable compositions based on epoxides |
| JP52322698A JP4001352B2 (ja) | 1996-11-21 | 1997-11-21 | エポキシド類を基剤とする重合可能な組成物 |
| DE59706867T DE59706867D1 (de) | 1996-11-21 | 1997-11-21 | Polymerisierbare massen auf der basis von epoxiden |
| EP97951256A EP0879257B1 (de) | 1996-11-21 | 1997-11-21 | Polymerisierbare massen auf der basis von epoxiden |
| US09/101,867 US6245828B1 (en) | 1996-11-21 | 1997-11-21 | Polymerizable compositions based on epoxides |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19648283.6 | 1996-11-21 | ||
| DE19648283A DE19648283A1 (de) | 1996-11-21 | 1996-11-21 | Polymerisierbare Massen auf der Basis von Epoxiden |
Related Child Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| US09/101,867 A-371-Of-International US6245828B1 (en) | 1996-11-21 | 1997-11-21 | Polymerizable compositions based on epoxides |
| US09/759,455 Division US20020002212A1 (en) | 1996-11-21 | 2001-01-16 | Polymerizable compositions based on epoxides |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO1998022521A1 true WO1998022521A1 (de) | 1998-05-28 |
Family
ID=7812400
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/EP1997/006504 WO1998022521A1 (de) | 1996-11-21 | 1997-11-21 | Polymerisierbare massen auf der basis von epoxiden |
Country Status (9)
| Country | Link |
|---|---|
| US (3) | US6245828B1 (de) |
| EP (1) | EP0879257B1 (de) |
| JP (1) | JP4001352B2 (de) |
| CN (1) | CN1106417C (de) |
| AT (1) | ATE215575T1 (de) |
| AU (1) | AU719390B2 (de) |
| CA (1) | CA2246163A1 (de) |
| DE (2) | DE19648283A1 (de) |
| WO (1) | WO1998022521A1 (de) |
Cited By (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001007444A1 (de) * | 1999-07-22 | 2001-02-01 | 3M Espe Ag | Hydrolysierbare und polymerisierbare silane mit geringer viskosität und deren verwendung |
| WO2002019040A2 (en) * | 2000-08-28 | 2002-03-07 | Aprilis, Inc. | Holographic storage medium comprising polyfunctional epoxy monomers capable of undergoing cationic polymerization |
| JP2002526621A (ja) * | 1998-10-07 | 2002-08-20 | ミネソタ マイニング アンド マニュファクチャリング カンパニー | 放射線遮断性充填剤を含む放射線不透過性カチオン重合性組成物およびそれを重合する方法 |
| US6566413B1 (en) * | 1998-12-24 | 2003-05-20 | 3M Espe Ag | Polymerisable materials which are based on hardenable siloxane compounds |
| US6765036B2 (en) | 2002-01-15 | 2004-07-20 | 3M Innovative Properties Company | Ternary photoinitiator system for cationically polymerizable resins |
| US7098259B2 (en) | 2001-01-09 | 2006-08-29 | 3M Espe Ag | Cationically curable dental materials |
| US7235602B2 (en) | 2001-02-19 | 2007-06-26 | 3M Espe Ag | Polymerizable preparations on the basis of silicon compounds comprising aliphatic and cycloaliphatic epoxide groups |
| US7368524B2 (en) | 2004-04-30 | 2008-05-06 | 3M Innovative Properties Company | Cationically curing two component materials containing a noble metal catalyst |
| EP2138525A1 (de) * | 2007-04-17 | 2009-12-30 | Asahi Kasei Chemicals Corporation | Epoxidsilikon und herstellungsverfahren dafür sowie härtbare harzzusammensetzung damit und verwendung |
| US7799846B2 (en) | 2004-07-14 | 2010-09-21 | 3M Espe Ag | Dental composition containing an epoxy functional carbosilane compound |
| US7825167B2 (en) | 2004-07-14 | 2010-11-02 | 3M Espe Ag | Dental composition containing unsaturated halogenated aryl alkyl ether components |
| US7939580B2 (en) * | 2004-07-14 | 2011-05-10 | 3M Innovative Properties Company | Dental composition containing epoxy functional polymerizable compounds |
| EP2757100A1 (de) * | 2011-09-14 | 2014-07-23 | Daicel Corporation | Triepoxidverbindung und verfahren zu ihrer herstellung |
| US9993393B2 (en) | 2005-12-29 | 2018-06-12 | 3M Innovative Properties Company | Dental compositions and initiator systems with polycyclic aromatic component |
Families Citing this family (83)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE19648283A1 (de) * | 1996-11-21 | 1998-05-28 | Thera Ges Fuer Patente | Polymerisierbare Massen auf der Basis von Epoxiden |
| DE19753461A1 (de) * | 1997-12-02 | 1999-06-10 | Espe Dental Ag | Lagerstabile kationisch polymerisierende Zubereitungen mit verbessertem Härtungsverhalten |
| FR2784025B1 (fr) * | 1998-10-02 | 2002-10-31 | Rhodia Chimie Sa | Composition dentaire a base d'une silicone fonctionnalisee reticulable/polymerisable par voie cationique |
| FR2784024B1 (fr) * | 1998-10-02 | 2002-10-31 | Rhodia Chimie Sa | Composition dentaire a base d'une silicone fonctionnalisee reticulable/polymerisable par voie cationique en presence d'un borate d'un complexe organometallique |
| DE19846556A1 (de) | 1998-10-09 | 2000-04-13 | Degussa | Dentalwerkstoff aufweisend poröse Glaskeramiken, poröse Glaskeramiken, Verfahren und Verwendung |
| DE19860361A1 (de) * | 1998-12-24 | 2000-06-29 | Espe Dental Ag | Vernetzbare Monomere auf Cyclosiloxanbasis, deren Herstellung und deren Verwendung in polymerisierbaren Massen |
| WO2000044807A1 (de) * | 1999-01-28 | 2000-08-03 | Siemens Aktiengesellschaft | Einkomponenten-klebstoff mit anpassbarer fügeoffenzeit |
| DE19912251A1 (de) * | 1999-03-18 | 2000-09-21 | Espe Dental Ag | Zweikomponentige Zubereitungen zur Herstellung von zahntechnischen Modellen |
| DE19937092A1 (de) | 1999-08-06 | 2001-02-08 | Espe Dental Ag | Adhäsivsysteme I |
| DE19937091A1 (de) | 1999-08-06 | 2001-02-22 | Espe Dental Ag | Adhäsivsysteme II |
| DE10001228B4 (de) * | 2000-01-13 | 2007-01-04 | 3M Espe Ag | Polymerisierbare Zubereitungen auf der Basis von siliziumhaltigen Epoxiden |
| US6699351B2 (en) | 2000-03-24 | 2004-03-02 | 3M Innovative Properties Company | Anisotropically conductive adhesive composition and anisotropically conductive adhesive film formed from it |
| JP2001279215A (ja) * | 2000-03-24 | 2001-10-10 | Three M Innovative Properties Co | 異方導電性接着剤組成物およびそれから形成された異方導電性接着フィルム |
| DE10144871A1 (de) * | 2001-09-12 | 2003-03-27 | Bosch Gmbh Robert | Vergußmasse mit hoher thermischer Stabilität |
| FR2833484B1 (fr) * | 2001-12-18 | 2004-12-10 | Rhodia Chimie Sa | Composition dentaire a base de solution de silice colloidale en phase continue silicone |
| US6835311B2 (en) | 2002-01-31 | 2004-12-28 | Koslow Technologies Corporation | Microporous filter media, filtration systems containing same, and methods of making and using |
| FR2857668B1 (fr) * | 2003-07-16 | 2006-01-13 | Commissariat Energie Atomique | Composition photopolymerisable a base d'une resine expoxyvinylester et d'une resine urethane acrylate et utilisation de ladite composition pour realiser des preformes et/ou des maquettes de protheses dentaires. |
| JP4289069B2 (ja) * | 2003-08-07 | 2009-07-01 | コニカミノルタエムジー株式会社 | 活性光線硬化型組成物、活性光線硬化型インク、それを用いた画像形成方法及びインクジェット記録装置 |
| JP2005060463A (ja) * | 2003-08-08 | 2005-03-10 | Konica Minolta Medical & Graphic Inc | 活性光線硬化型組成物、活性光線硬化型インク、それを用いた画像形成方法及びインクジェット記録装置 |
| JP2005060462A (ja) * | 2003-08-08 | 2005-03-10 | Konica Minolta Medical & Graphic Inc | 活性光線硬化型組成物、活性光線硬化型インク、それを用いた画像形成方法及びインクジェット記録装置 |
| EP1547572B1 (de) * | 2003-12-22 | 2007-08-15 | 3M Espe AG | Glasfüllmaterial und Verfahren zur Herstellung |
| US20050250929A1 (en) * | 2004-05-10 | 2005-11-10 | 3M Innovative Properties Company | Ferrocenium-derived catalyst for cationically polymerizable monomers |
| US20050261390A1 (en) * | 2004-05-13 | 2005-11-24 | Jean-Marc Frances | Stable cationically crosslinkable/polymerizable dental composition with a high filler content |
| US7893130B2 (en) * | 2004-05-13 | 2011-02-22 | Bluestar Silicones France Sas | Photocurable dental composition |
| ATE539381T1 (de) * | 2004-06-01 | 2012-01-15 | Dow Corning | Materialzusammensetzung für nano- und mikrolithografie |
| CN1988874A (zh) * | 2004-07-14 | 2007-06-27 | 3M埃斯佩股份公司 | 含有含不饱和碳硅烷的组分的牙科组合物 |
| US8003711B2 (en) * | 2004-07-14 | 2011-08-23 | 3M Innovative Properties Company | Dental composition containing Si-H functional carbosilane components |
| WO2006019797A1 (en) * | 2004-07-14 | 2006-02-23 | 3M Innovative Properties Company | Dental compositions containing oxirane monomers |
| CA2573493A1 (en) | 2004-07-14 | 2006-02-23 | 3M Innovative Properties Company | Dental compositions containing carbosilane polymers |
| AU2004321429A1 (en) * | 2004-07-14 | 2006-01-19 | 3M Espe Ag | Dental composition containing unsaturated carbosilane containing components |
| JP4819806B2 (ja) * | 2004-07-14 | 2011-11-24 | スリーエム イノベイティブ プロパティズ カンパニー | カルボシランモノマーを含有する歯科用組成物 |
| EP1639987B1 (de) * | 2004-09-24 | 2009-08-12 | 3M Espe AG | Dentalklebstoffzusammensetzung |
| JP4967660B2 (ja) * | 2004-10-04 | 2012-07-04 | 東亞合成株式会社 | シクロヘキシル基または長鎖アルキル基を有するシクロヘキセンオキサイド化合物とその用途 |
| US20060205838A1 (en) * | 2005-03-10 | 2006-09-14 | Velamakanni Bhaskar V | Hardenable antimicrobial dental compositions and methods |
| US20060204452A1 (en) * | 2005-03-10 | 2006-09-14 | Velamakanni Bhaskar V | Antimicrobial film-forming dental compositions and methods |
| DE102005022172A1 (de) * | 2005-05-13 | 2006-11-16 | Voco Gmbh | Haftverbessernde Additive für polymerisierbare Zusammensetzungen |
| JP2007084665A (ja) * | 2005-09-21 | 2007-04-05 | Fujifilm Corp | 硬化性組成物、インク組成物、インクジェット記録方法、印刷物、平版印刷版の製造方法、及び平版印刷版 |
| US20070072954A1 (en) * | 2005-09-29 | 2007-03-29 | Curators Of The University Of Missouri | Novel tetraoxaspiroalkanes and methods of use with organosilicon monomers in polyerizable compositions |
| US20070142498A1 (en) * | 2005-12-20 | 2007-06-21 | Brennan Joan V | Dental compositions including thermally responsive additives, and the use thereof |
| US8026296B2 (en) | 2005-12-20 | 2011-09-27 | 3M Innovative Properties Company | Dental compositions including a thermally labile component, and the use thereof |
| US7776940B2 (en) * | 2005-12-20 | 2010-08-17 | 3M Innovative Properties Company | Methods for reducing bond strengths, dental compositions, and the use thereof |
| US7896650B2 (en) * | 2005-12-20 | 2011-03-01 | 3M Innovative Properties Company | Dental compositions including radiation-to-heat converters, and the use thereof |
| DE102007035734A1 (de) | 2006-08-29 | 2008-03-20 | Ivoclar Vivadent Ag | Dentalmaterialien mit geringem Polymerisationsschrumpf |
| CN100584301C (zh) * | 2006-10-04 | 2010-01-27 | 中国科学院长春应用化学研究所 | 一种可见光固化纳米复合树脂牙体修复材料及制备方法 |
| US9539065B2 (en) | 2006-10-23 | 2017-01-10 | 3M Innovative Properties Company | Assemblies, methods, and kits including a compressible material |
| US20080096150A1 (en) | 2006-10-23 | 2008-04-24 | 3M Innovative Properties Company | Dental articles, methods, and kits including a compressible material |
| CN101529957B (zh) * | 2006-11-01 | 2012-07-04 | 富士通株式会社 | 无线通信装置和无线通信方法 |
| EP2114350A1 (de) * | 2006-12-28 | 2009-11-11 | 3M Innovative Properties Company | (meth)acryloyl-haltige stoffe, zusammensetzungen und verfahren |
| US20110229838A1 (en) * | 2007-10-01 | 2011-09-22 | Kalgutkar Rajdeep S | Orthodontic composition with polymeric fillers |
| KR101800015B1 (ko) | 2007-12-10 | 2017-11-21 | 카네카 코포레이션 | 알칼리 현상성을 갖는 경화성 조성물 및 그것을 사용한 절연성 박막 및 박막 트랜지스터 |
| KR101451805B1 (ko) * | 2008-01-25 | 2014-10-16 | 삼성에스디아이 주식회사 | 리튬이차전지 전해질용 첨가제, 이를 포함하는 유기 전해액및 상기 전해액을 채용한 리튬 전지 |
| EP2133063A1 (de) | 2008-06-10 | 2009-12-16 | 3M Innovative Properties Company | Initiatorsystem mit Biphenylen-Derivaten, Herstellungsverfahren und Verwendung dafür |
| EP2133064A1 (de) * | 2008-06-10 | 2009-12-16 | 3M Innovative Properties Company | Initiatorsystem mit einem Diarylalkylamin-Derivat, härtbare Zusammensetzung und deren Verwendung |
| KR101604505B1 (ko) * | 2008-07-03 | 2016-03-17 | 쓰리엠 이노베이티브 프로퍼티즈 컴파니 | 고정 연마 입자 및 그로부터 제조된 물품 |
| EP2151214B1 (de) | 2008-07-30 | 2013-01-23 | Ivoclar Vivadent AG | Lichthärtende Schlicker für die stereolithographische Herstellung von Dentalkeramiken |
| CN102196799B (zh) * | 2008-09-04 | 2013-02-06 | 3M创新有限公司 | 含有联苯二(甲基)丙烯酸酯单体的牙科用组合物 |
| EP2341885A2 (de) * | 2008-09-30 | 2011-07-13 | 3M Innovative Properties Company | Kieferorthopädische zusammensetzung mit wärmemodifizierten mineralien |
| US8809414B2 (en) | 2008-10-02 | 2014-08-19 | Kaneka Corporation | Photocurable composition and cured product |
| BRPI0914464A2 (pt) * | 2008-10-22 | 2015-10-27 | 3M Innovative Properties Co | "composição dentária endurecível, artigos dentários e monômero bifenil di(met)acrilato" |
| JP5210122B2 (ja) * | 2008-10-31 | 2013-06-12 | 昭和電工株式会社 | 接着剤用硬化性組成物 |
| WO2010121001A1 (en) * | 2009-04-17 | 2010-10-21 | 3M Innovative Properties Company | Planar abrasive articles made using transfer articles and method of making the same |
| DE102009035970A1 (de) | 2009-08-04 | 2011-02-17 | Heraeus Kulzer Gmbh | Antimikrobiell ausgestattete Dentalmaterialien, insbesondere zur Verhinderung von Plaqueanlagerungen |
| WO2011087477A1 (en) * | 2009-12-22 | 2011-07-21 | Dow Global Technologies Llc | Substantially solvent-free epoxy formulations |
| US8198361B2 (en) * | 2010-01-27 | 2012-06-12 | Momentive Performance Materials Inc. | Silicon polyethers and a method of producing the same |
| EP3649980B1 (de) | 2010-12-30 | 2021-08-11 | 3M Innovative Properties Co. | Dentale klebefähige anordnungen mit einem komprimierbaren material |
| TWI557183B (zh) * | 2015-12-16 | 2016-11-11 | 財團法人工業技術研究院 | 矽氧烷組成物、以及包含其之光電裝置 |
| US20140017637A1 (en) | 2011-03-24 | 2014-01-16 | 3M Iinnovative Properties Company | Dental adhesive comprising a coated polymeric component |
| CN102503911A (zh) * | 2011-12-01 | 2012-06-20 | 江苏三木化工股份有限公司 | 阳离子光固化脂环族环氧化合物及其制备方法 |
| JP5841488B2 (ja) * | 2012-05-11 | 2016-01-13 | 信越化学工業株式会社 | ブロック型変性オルガノポリシロキサン、該オルガノポリシロキサンの使用方法、化粧料、及び前記オルガノポリシロキサンの製造方法 |
| CN107674206B (zh) | 2012-08-31 | 2021-05-25 | 株式会社大赛璐 | 固化性组合物及其固化物、光学构件以及光学装置 |
| KR20160127733A (ko) | 2014-02-28 | 2016-11-04 | 주식회사 다이셀 | 경화성 조성물 및 그의 경화물, 및 웨이퍼 레벨 렌즈 |
| JP6602865B2 (ja) * | 2015-07-10 | 2019-11-06 | 住友精化株式会社 | エポキシ樹脂組成物、その製造方法、及び該組成物の用途 |
| CN110177819B (zh) | 2017-01-10 | 2022-11-08 | 住友精化株式会社 | 环氧树脂组合物 |
| EP3569653B1 (de) | 2017-01-10 | 2021-03-10 | Sumitomo Seika Chemicals Co. Ltd. | Epoxidharzzusammensetzung |
| WO2018131563A1 (ja) | 2017-01-10 | 2018-07-19 | 住友精化株式会社 | エポキシ樹脂組成物 |
| KR102459581B1 (ko) | 2017-01-10 | 2022-10-27 | 스미토모 세이카 가부시키가이샤 | 에폭시 수지 조성물 |
| EP3536305A1 (de) * | 2018-03-07 | 2019-09-11 | Dentsply DeTrey GmbH | Zahnärztliches druckmaterial |
| EP3660087A1 (de) | 2018-11-29 | 2020-06-03 | Ivoclar Vivadent AG | Verfahren und werkstoff zur herstellung von 3d objekten durch energieimpuls-induzierten transferdruck |
| EP3660085A1 (de) | 2018-11-29 | 2020-06-03 | Ivoclar Vivadent AG | Stützmaterial für den energieimpuls-induzierten transferdruck |
| DE102019122174A1 (de) | 2019-08-19 | 2021-02-25 | Voco Gmbh | Dentale polymerisierbare Zusammensetzung auf der Basis kondensierter Silane |
| CN111454689B (zh) * | 2019-12-31 | 2021-10-15 | 武汉长盈鑫科技有限公司 | 一种高玻璃化温度的导热胶及其制备方法 |
| EP4271322A1 (de) | 2020-12-30 | 2023-11-08 | 3M Innovative Properties Company | Verbindbare orthodontische anordnungen und verfahren zum verbinden |
| FR3131585A1 (fr) * | 2021-12-30 | 2023-07-07 | Arkema France | Époxydes cycloaliphatiques polymériques |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0394192A2 (de) * | 1989-04-17 | 1990-10-24 | Ciba-Geigy Ag | Härtbares Gemisch auf Basis von cycloaliphatischen Epoxidharzen |
| EP0532896A2 (de) * | 1991-09-05 | 1993-03-24 | International Business Machines Corporation | Spaltbare Diepoxyde als entfernbarer Vorrichtungsschutz für elektronisches Gehäuse |
| WO1995030402A1 (en) * | 1994-05-05 | 1995-11-16 | Oraleg Ab | Photopolymerizable composition |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3449274A (en) * | 1967-04-04 | 1969-06-10 | Union Carbide Corp | Curable,thixotropic compositions based on cycloaliphatic diepoxides and dimers of unsaturated fatty acids |
| US3956317A (en) * | 1970-02-13 | 1976-05-11 | Ciba-Geigy Ag | Diepoxides, processes for their manufacture and use |
| US4279717A (en) * | 1979-08-03 | 1981-07-21 | General Electric Company | Ultraviolet curable epoxy silicone coating compositions |
| CH650398A5 (fr) * | 1980-10-09 | 1985-07-31 | G C Dental Ind Corp | Composition de resine destinee a la preparation d'un materiau pour la base d'un dentier. |
| US4576999A (en) * | 1982-05-06 | 1986-03-18 | General Electric Company | Ultraviolet radiation-curable silicone release compositions with epoxy and/or acrylic functionality |
| EP0381096A3 (de) * | 1989-01-30 | 1991-12-04 | Cappar Limited | Zusatz für Zweikomponentenepoxydharzzusammensetzungen |
| DD290579A5 (de) * | 1989-12-22 | 1991-06-06 | Akad Wissenschaften Ddr | Haftvermittler fuer die stomatologische prothetik und dessen verwendung als dentalbindemittel |
| US4990546A (en) * | 1990-03-23 | 1991-02-05 | General Electric Company | UV-curable silphenylene-containing epoxy functional silicones |
| US5260349A (en) * | 1991-01-04 | 1993-11-09 | Polyset Corporation | Electron beam curable epoxy compositions |
| DE4124806A1 (de) * | 1991-07-26 | 1993-01-28 | Bayer Ag | Verfahren zum beschichten von polycarbonatformkoerpern |
| DE4133494C2 (de) * | 1991-10-09 | 1996-03-28 | Fraunhofer Ges Forschung | Dentalharzmasse, Verfahren zu deren Herstellung und deren Verwendung |
| US5411996A (en) * | 1992-06-25 | 1995-05-02 | General Electric Company | One-part UV-curable epoxy silicone compositions containing a fluorinated alcohol |
| US5556896A (en) * | 1993-07-01 | 1996-09-17 | The Curators Of The University Of Missouri | Polymeric compositions and composites prepared from spiroortho-carbonates and epoxy monomers |
| DE4324322B4 (de) * | 1993-07-20 | 2005-11-24 | Delo Industrieklebstoffe Gmbh & Co. Kg | Flexibilisierte, lichtinitiiert härtende Epoxidharzmassen, ihre Herstellung und Verwendung |
| DE4405148C1 (de) * | 1994-02-18 | 1995-05-11 | Herberts Gmbh | Wäßrige einkomponentige Überzugsmittel und deren Verwendung |
| DE4421623A1 (de) * | 1994-06-21 | 1996-01-04 | Thera Ges Fuer Patente | Mehrkomponentige, kationisch härtende Epoxidmassen und deren Verwendung sowie Verfahren zur Herstellung gehärteter Massen |
| ES2154352T3 (es) * | 1994-10-31 | 2001-04-01 | Minnesota Mining & Mfg | Sistema epoxi, curable con luz visible, con profundidad de curado aumentada. |
| US5856373A (en) * | 1994-10-31 | 1999-01-05 | Minnesota Mining And Manufacturing Company | Dental visible light curable epoxy system with enhanced depth of cure |
| US5770706A (en) * | 1995-06-07 | 1998-06-23 | National Starch And Chemical Investment Holding Corporation | Snap-cure epoxy adhesives |
| DE19534668A1 (de) * | 1995-09-19 | 1997-03-20 | Thera Ges Fuer Patente | Kettenverlängerte Epoxidharze enthaltende, vorwiegend kationisch härtende Masse |
| GB9600771D0 (en) * | 1996-01-13 | 1996-03-20 | Lucas Ind Plc | Fuel pump |
| DE19648283A1 (de) * | 1996-11-21 | 1998-05-28 | Thera Ges Fuer Patente | Polymerisierbare Massen auf der Basis von Epoxiden |
-
1996
- 1996-11-21 DE DE19648283A patent/DE19648283A1/de not_active Withdrawn
-
1997
- 1997-11-21 AU AU54849/98A patent/AU719390B2/en not_active Ceased
- 1997-11-21 CN CN97191799A patent/CN1106417C/zh not_active Expired - Fee Related
- 1997-11-21 US US09/101,867 patent/US6245828B1/en not_active Expired - Lifetime
- 1997-11-21 WO PCT/EP1997/006504 patent/WO1998022521A1/de active IP Right Grant
- 1997-11-21 AT AT97951256T patent/ATE215575T1/de not_active IP Right Cessation
- 1997-11-21 CA CA002246163A patent/CA2246163A1/en not_active Abandoned
- 1997-11-21 DE DE59706867T patent/DE59706867D1/de not_active Expired - Lifetime
- 1997-11-21 EP EP97951256A patent/EP0879257B1/de not_active Expired - Lifetime
- 1997-11-21 JP JP52322698A patent/JP4001352B2/ja not_active Expired - Fee Related
-
2001
- 2001-01-16 US US09/759,455 patent/US20020002212A1/en not_active Abandoned
-
2003
- 2003-03-18 US US10/389,814 patent/US6908953B2/en not_active Expired - Fee Related
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0394192A2 (de) * | 1989-04-17 | 1990-10-24 | Ciba-Geigy Ag | Härtbares Gemisch auf Basis von cycloaliphatischen Epoxidharzen |
| EP0532896A2 (de) * | 1991-09-05 | 1993-03-24 | International Business Machines Corporation | Spaltbare Diepoxyde als entfernbarer Vorrichtungsschutz für elektronisches Gehäuse |
| WO1995030402A1 (en) * | 1994-05-05 | 1995-11-16 | Oraleg Ab | Photopolymerizable composition |
Cited By (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002526621A (ja) * | 1998-10-07 | 2002-08-20 | ミネソタ マイニング アンド マニュファクチャリング カンパニー | 放射線遮断性充填剤を含む放射線不透過性カチオン重合性組成物およびそれを重合する方法 |
| US6566413B1 (en) * | 1998-12-24 | 2003-05-20 | 3M Espe Ag | Polymerisable materials which are based on hardenable siloxane compounds |
| WO2001007444A1 (de) * | 1999-07-22 | 2001-02-01 | 3M Espe Ag | Hydrolysierbare und polymerisierbare silane mit geringer viskosität und deren verwendung |
| US6852822B1 (en) | 1999-07-22 | 2005-02-08 | 3M Espe Ag | Hydrolyzable silanes and polymerizable silanes with low viscosity and use thereof |
| WO2002019040A3 (en) * | 2000-08-28 | 2002-05-30 | Aprilis Inc | Holographic storage medium comprising polyfunctional epoxy monomers capable of undergoing cationic polymerization |
| WO2002019040A2 (en) * | 2000-08-28 | 2002-03-07 | Aprilis, Inc. | Holographic storage medium comprising polyfunctional epoxy monomers capable of undergoing cationic polymerization |
| JP2004507513A (ja) * | 2000-08-28 | 2004-03-11 | アプリリス,インコーポレイテッド | カチオン性重合を行いうる多官能エポキシモノマーを含むホログラフィー蓄積媒体 |
| US7332249B2 (en) | 2000-08-28 | 2008-02-19 | Aprilis, Inc. | Holographic storage medium comprising polyfunctional epoxy monomers capable of undergoing cationic polymerization |
| US6784300B2 (en) | 2000-08-28 | 2004-08-31 | Aprilis, Inc. | Holographic storage medium comprising polyfunctional epoxy monomers capable of undergoing cationic polymerization |
| US7070886B2 (en) | 2000-08-28 | 2006-07-04 | Aprilis, Inc. | Holographic storage medium comprising polyfunctional epoxy monomers capable of undergoing cationic polymerization |
| KR100749304B1 (ko) * | 2000-08-28 | 2007-08-14 | 디시이 아프릴리스, 인코포레이티드 | 양이온 중합반응을 수행할 수 있는 다작용성 에폭시모노머를 포함하는 홀로그래픽 기록 매체 |
| US7098259B2 (en) | 2001-01-09 | 2006-08-29 | 3M Espe Ag | Cationically curable dental materials |
| US7235602B2 (en) | 2001-02-19 | 2007-06-26 | 3M Espe Ag | Polymerizable preparations on the basis of silicon compounds comprising aliphatic and cycloaliphatic epoxide groups |
| US6765036B2 (en) | 2002-01-15 | 2004-07-20 | 3M Innovative Properties Company | Ternary photoinitiator system for cationically polymerizable resins |
| US7368524B2 (en) | 2004-04-30 | 2008-05-06 | 3M Innovative Properties Company | Cationically curing two component materials containing a noble metal catalyst |
| US7799846B2 (en) | 2004-07-14 | 2010-09-21 | 3M Espe Ag | Dental composition containing an epoxy functional carbosilane compound |
| US7825167B2 (en) | 2004-07-14 | 2010-11-02 | 3M Espe Ag | Dental composition containing unsaturated halogenated aryl alkyl ether components |
| US7939580B2 (en) * | 2004-07-14 | 2011-05-10 | 3M Innovative Properties Company | Dental composition containing epoxy functional polymerizable compounds |
| US9993393B2 (en) | 2005-12-29 | 2018-06-12 | 3M Innovative Properties Company | Dental compositions and initiator systems with polycyclic aromatic component |
| EP2138525A1 (de) * | 2007-04-17 | 2009-12-30 | Asahi Kasei Chemicals Corporation | Epoxidsilikon und herstellungsverfahren dafür sowie härtbare harzzusammensetzung damit und verwendung |
| EP2138525A4 (de) * | 2007-04-17 | 2012-03-14 | Asahi Kasei Chemicals Corp | Epoxidsilikon und herstellungsverfahren dafür sowie härtbare harzzusammensetzung damit und verwendung |
| US8222348B2 (en) | 2007-04-17 | 2012-07-17 | Asahi Kasei Chemicals Corporation | Epoxy silicone and process for producing same, and curable mix composition using same and use thereof |
| EP2757100A1 (de) * | 2011-09-14 | 2014-07-23 | Daicel Corporation | Triepoxidverbindung und verfahren zu ihrer herstellung |
| EP2757100A4 (de) * | 2011-09-14 | 2015-04-29 | Daicel Corp | Triepoxidverbindung und verfahren zu ihrer herstellung |
| US9249256B2 (en) | 2011-09-14 | 2016-02-02 | Daicel Corporation | Triepoxy compound and method for producing same |
Also Published As
| Publication number | Publication date |
|---|---|
| US6908953B2 (en) | 2005-06-21 |
| EP0879257A1 (de) | 1998-11-25 |
| CN1106417C (zh) | 2003-04-23 |
| AU719390B2 (en) | 2000-05-11 |
| US6245828B1 (en) | 2001-06-12 |
| DE19648283A1 (de) | 1998-05-28 |
| EP0879257B1 (de) | 2002-04-03 |
| DE59706867D1 (de) | 2002-05-08 |
| US20040024113A1 (en) | 2004-02-05 |
| JP4001352B2 (ja) | 2007-10-31 |
| AU5484998A (en) | 1998-06-10 |
| JP2001513117A (ja) | 2001-08-28 |
| US20020002212A1 (en) | 2002-01-03 |
| CN1209821A (zh) | 1999-03-03 |
| ATE215575T1 (de) | 2002-04-15 |
| CA2246163A1 (en) | 1998-05-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0879257B1 (de) | Polymerisierbare massen auf der basis von epoxiden | |
| EP1368402B1 (de) | Polymerisiebare zubereitungen auf der basis von siliziumverbindungen mit aliphatischen und cycloaliphatischen epoxidgruppen | |
| DE19860364C2 (de) | Polymerisierbare Dentalmassen auf der Basis von zur Aushärtung befähigten Siloxanverbindungen, deren Verwendung und Herstellung | |
| EP1246859B1 (de) | Polymerisierbare dentalmassen auf basis von siliziumhaltigen epoxiden | |
| EP0897710B1 (de) | Lichtinduziert kationisch härtende Zusammensetzungen und deren Verwendung | |
| EP1284979B1 (de) | Präpolymere (meth)acrylate mit polycyclischen oder aromatischen segmenten | |
| DE60312814T2 (de) | Ternäres photoinitiatorsystem für kationisch polymerisierbare harze | |
| US6075068A (en) | Dental compositions curable by ROMP | |
| EP0060911B1 (de) | Dentales Füllungsmaterial | |
| AU744316B2 (en) | Ternary photoinitiator system for curing of epoxy/polyol resin compositions | |
| EP0968459B1 (de) | Ternäres photoinitiatorsystem zum härten von epoxidharzen | |
| EP0044352A1 (de) | Addukte aus Diisocyanaten und Methacryloylalkylethern, -alkoxybenzolen bzw. -alkoxycycloalkanen und deren Verwendung | |
| EP0091990B1 (de) | Dentales Restorationsmaterial | |
| EP0904767B1 (de) | Dentalmassen auf der Basis von ROMP-Oligomeren oder -Polymeren | |
| EP1905415A1 (de) | Polymerisierbare Zusammensetzungen mit Acylgermanium-Verbindungen als Initiatoren | |
| EP1138309A2 (de) | Dentalwerkstoff auf Basis von kationisch polymerisierbaren Monomeren |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WWE | Wipo information: entry into national phase |
Ref document number: 97191799.X Country of ref document: CN |
|
| AK | Designated states |
Kind code of ref document: A1 Designated state(s): AU CA CN JP US |
|
| AL | Designated countries for regional patents |
Kind code of ref document: A1 Designated state(s): AT BE CH DE DK ES FI FR GB GR IE IT LU MC NL PT SE |
|
| ENP | Entry into the national phase |
Ref document number: 2246163 Country of ref document: CA Ref document number: 2246163 Country of ref document: CA Kind code of ref document: A |
|
| ENP | Entry into the national phase |
Ref document number: 1998 523226 Country of ref document: JP Kind code of ref document: A |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 1997951256 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 54849/98 Country of ref document: AU |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 09101867 Country of ref document: US |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application | ||
| WWP | Wipo information: published in national office |
Ref document number: 1997951256 Country of ref document: EP |
|
| WWG | Wipo information: grant in national office |
Ref document number: 54849/98 Country of ref document: AU |
|
| WWG | Wipo information: grant in national office |
Ref document number: 1997951256 Country of ref document: EP |